Pile
1) In quanti modi è possibile il passaggio degli elettroni dalla forma ridotta di una coppia coniugata alla forma ossidata della altra :
a) Direttamente, mescolando le soluzioni contenenti le 2 coppie coniugate di ossidoriduzione, in questo caso gli elettroni passano rapidamente da una molecola alla altra, non è possibile ricavarne alcun lavoro elettrico e l‘equilibrio viene inoltre raggiunto rapidamente.
b) Indirettamente in un dispositivo elettrochimico quale la pila che consente di sfruttare il lavoro elettrico generato dal flusso di elettroni che viene convogliato in un piccolo condotto e pertanto la reazione può durare a lungo.
2) Scrivere la reazione di riduzione del rame :
Cu2+ + 2e ® Cu(S)
3) Scrivere la reazione di ossidazione del rame :
Cu(S) ® Cu2+ + 2e
4) Cosa è una pila:
Una pila è un dispositivo elettrochimico che consente di utilizzare il lavoro elettrico sviluppato nel corso delle reazioni di ossidoriduzione mediante separazione della soluzione che si riduce da quella che si ossida e loro collegamento unicamente tramite elettrodi collegati al circuito utilizzatore. Il circuito viene chiuso tramite un ponte salino che consente il trasferimento degli ioni ma non consente l´unione fisica delle 2 soluzioni.
5) In che modo viene descritto il generico semielemento:
Elettrodo | forma ossidata : forma ridotta |
dove la forma ossidata è quella che ha n° di ossidazione più elevato.
6) Che elettrodo si utilizza se sia la forma ossidata che la forma ridotta sono allo stato di soluzione:
Si utilizza un elettrodo di un metallo inerte quale il platino Pt. In questo caso viene detto elettrodo ad ossidoriduzione.
7) Che elettrodo si utilizza quando la forma ridotta è un metallo:
Si utilizza un elettrodo costituito dallo stesso metallo. Viene chiamato elettrodo di 1ª specie.
8) Cosa è un elettrodo di 2ª specie:
È un elettrodo formato da un metallo immerso in una soluzione satura di un suo sale poco solubile, nella soluzione è disciolto inoltre un elettrolita contenente la anione del sale poco solubile.
Ad esempio l´elettrodo : Ag | AgCl(S) |
| HCl (0,1M) |
dove le reazioni sono Ag+ + e « Ag(S)
e AgCl(S) + e « Ag+ + Cl- pertanto la reazione globale è :
AgCl(S) + e « Ag(S) + Cl-
9) Che elettrodo si utilizza se la forma ossidata o la forma ridotta sono allo stato gassoso:
Si utilizza un elettrodo di un metallo inerte quale il platino Pt e su di esso si fa gorgogliare il gas. Viene chiamato elettrodo a gas.
10) Come si schematizza una pila:
Semplicemente unendo le rappresentazioni dei suoi 2 semielementi.
11) In una pila quale semielemento si comporta da catodo e quale da anodo:
L´elettrodo presso il quale avviene la ossidazione si comporta da anodo dalla parola greca che significa verso la alto, esso è a potenziale più basso rispetto al catodo, ossia la altro elettrodo presso il quale avviene la reazione di riduzione, catodo deriva dalla parola greca che vuol dire verso il basso, si trova a potenziale più elevato in modo da attrarre gli elettroni sviluppati nella ossidazione della anodo.
12) Cosa è la forza elettromotrice di una pila:
È la differenza di potenziale misurata ai capi dei 2 elettrodi a circuito aperto. E = ECATODO - EANODO , essa è sempre positiva in quanto il catodo si trova a potenziale più elevato per definizione.
13) Cosa è un elettrodo normale:
È un elettrodo nel quale tutte le attività delle sostanze interessate alla semireazione sono unitarie, ciò vuol dire che
a) le sostanze in soluzione debbono avere concentrazione 1M
b) le sostanze allo stato gassoso debbono avere la pressione di 1 atm.
14) Cosa è il potenziale normale di un semielemento:
È il potenziale di un elettrodo normale, si indica ad esempio E°CU2+/CU esso rappresenta come tutte le funzioni potenziali una funzione di stato che pertanto dipende unicamente dallo stato iniziale e finale ed è esprimibile unicamente in termini di una variazione, per tale motivo è stato necessario scegliere un potenziale di riferimento E°H+/H2 = 0 v .
15) Descrivere l´elettrodo di riferimento NHE :
È l´elettrodo normale ad idrogeno formato da una lamina di Pt in contatto con H2 gassoso alla pressione di 1 atm ed immerso in una soluzione di H3O+ avente attività unitaria.
16) Cosa si intende con la acronimo SCE :
S´intende Standard Calomelano Electrode, o elettrodo standard di 2ª specie a calomelano.
17) Per un processo chimico reversibile quale quello realizzabile in una pila tramite il metodo potenziometrico, quanto vale il calore scambiato e quanto vale il lavoro utile:
Il calore scambiato è Q = TDS mentre il lavoro utile è LU = -DG
18) Per un processo chimico irreversibile quale quello realizzabile tramite miscelazione di 2 soluzioni di reattivi, quanto vale il calore scambiato e quanto vale il lavoro utile:
Il calore scambiato è Q = DH mentre il lavoro utile è LU = 0..
19) Come calcolare il potenziale di un dato semielemento:
Si utilizza la formula di Nernst ![]() dove n è il n° di elettroni scambiati, a indica la attività elevata al corrispondente coefficiente stechiometrico.
dove n è il n° di elettroni scambiati, a indica la attività elevata al corrispondente coefficiente stechiometrico.
20) Cosa è il potenziale di riduzione, il potenziale di ossidazione e che legame c´è tra i 2 potenziali :
Il potenziale di riduzione è quello associato alla reazione di riduzione di una determinata coppia ossidoriduttiva mentre il potenziale di ossidazione è quello collegato alla reazione di ossidazione della medesima coppia, essi sono uguali in modulo ma di segno opposto.
21) Come si valuta quale è la anodo e quale il catodo per una pila:
Si scrivono le reazioni di riduzione per entrambe gli elettrodi e se ne calcola il potenziale di riduzione, quello più positivo è associato al catodo dove dovrà avvenire la reazione di riduzione e pertanto la reazione è spontanea nel senso in cui è scritta, la altro elettrodo è la anodo, su di esso avverrà la ossidazione e quindi la reazione è spontanea nel verso opposto a quello in cui è attualmente scritta, in definitiva la reazione di ossidoriduzione spontanea è la somma della reazione del 1° elettrodo per la reazione inversa del 2° elettrodo.
22) Cosa è una pila a concentrazione:
È una pila nella quale i 2 semielementi sono identici mentre cambiano le attività vale a dire possono presentarsi le :
a) Concentrazioni diverse ; ![]()
b) Pressioni diverse ; 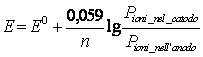
23) Quanto vale la variazione di energia libera standard per una qualsiasi reazione di ossidoriduzione:
DG° = -n F DE°
con DE° = E°CATODO - E°ANODO dove chi sia la anodo e chi sia il catodo si ricava dall´osservazione di quale specie si riduce nel verso in cui è scritta la reazione, tale specie figurerà al catodo.
Con F costante di faraday pari a 96500 Coulomb si ottiene una DG° espressa in Joule / Mole, per passarla a Kcal / Mole occorre dividere per 4184.
24) Come valutare la spontaneità di una reazione ossidoriduttiva:
Occorre calcolare 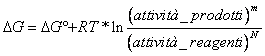 dove al solito la attività corrisponde alla pressione per i gas ed alla concentrazione per le soluzioni mentre è unitaria per i componenti allo stato di liquido o solido.
dove al solito la attività corrisponde alla pressione per i gas ed alla concentrazione per le soluzioni mentre è unitaria per i componenti allo stato di liquido o solido.
DG° è calcolabile dalla DG° = -n F DE° dove DE° = E°CATODO - E°ANODO .
25) Quanto vale la costante di equilibrio per una qualunque reazione di ossidoriduzione:
![]() che a 25° espressa in termini di logaritmi decimali diviene
che a 25° espressa in termini di logaritmi decimali diviene ![]()
26) Quali concentrazioni occorre considerare nel calcolo della Kc di una pila:
La Kc è riferita alle concentrazioni relative all´equilibrio pertanto occorre considerare la pila scarica ossia avente i due elettrodi allo stesso potenziale.
27) Quanto vale R nella DG° = -RT ln K :
Vale 8,31 Joule / Mole .
28) Cosa accade ad una pila che eroga 1 Ampere per 4 ore :
1 Ampere per 4 ore significa erogare 1 Ampere * 4 * 3600sec = 14400 Coulomb , datosi che l´erogazione di 96500 Coulomb prevede la scomparsa di una mole di sostanze acide, ne consegue che scomparranno 14400 / 96500 moli di sostanze acide a causa del processo di riduzione ed altrettante invece se ne formeranno della forma ossidata.
29) Le moli di sostanza che si riducono al catodo sono uguali alle moli che si ossidano alla anodo:
No, bisogna impostare la proporzione individualmente perchè ad esempio ad ogni mole di Ca2+ corrispondono 2 moli di elettroni mentre " mole di Ag+ corrisponde una mole di elettroni.
30) Come si deduce il processo ossidoridutivo spontaneo:
Si scrivono per entrambe gli elettrodi le reazioni di riduzione, si calcola il potenziale associato alle singole reazioni, l´elettrodo a potenziale più elevato è il catodo ed in esso avviene spontaneamente la riduzione così come è già scritta, mentre nella anodo avviene la ossidazione ed occorre pertanto scrivere la riduzione inversa. La reazione di ossidoriduzione spontanea è la somma delle 2 semireazioni così scritte.
31) Cosa accade ad un catodo, in presenza di più coppie ossidoriduttive:
Si riduce la coppia ossidoriduttiva con potenziale normale più elevato.
32) Quale concetto lega le pile al prodotto di solubilità:
Tramite il prodotto di solubilità si riesce a calcolare la concentrazione di un determinato ione il che talvolta è molto utile per la determinazione del potenziale della elettrodo tramite la equazione di Nernst.
33) Cosa è un accumulatore al piombo:
È la batteria della macchina, una pila caratterizzata dal fatto che i prodotti delle reazioni che avvengono agli elettrodi rimangono attaccati agli elettrodi stessi pertanto se si fornisce una corrente continua alla pila tramite il fenomeno della elettrolisi si può riportare la batteria alle condizioni iniziali.
