Acidi e basi
1) Cosa è un acido:
Una qualsiasi specie chimica capace di cedere un protone (ione H+) ad una base.
2) Cosa è una base:
Una qualsiasi specie chimica capace di accettare il protone ceduto da un acido.
3) Cosa si intende per coppia coniugata:
Si intende che un acido per perdita del protone si trasforma in una base ed in maniera analoga la base per acquisto di un protone si trasforma in un acido. La coppia coniugata è quindi costituita da un acido coniugato e da una base coniugata.
4) Cosa si intende per sostanza anfolita:
Si intende una sostanza come la acqua o la ammoniaca che possono reagire sia come acidi che come basi.
5) Cosa si intende per forza di un acido:
La forza di un acido è una misura della sua capacità a cedere un protone.
6) Cosa si intende per forza di una base:
La forza di una base è una misura della sua capacità a legare un protone.
7) Come si misura la forza di un acido rispetto a quella di un altro acido:
Occorre fissare un riferimento ossia una coppia acido / base sotto forma di solvente, normalmente la acqua e calcolare la costante di ionizzazione della reazione  dove appunto si è supposta la concentrazione della acqua costante. Da questa relazione non si fà altro che confrontare HA con H3O+ infatti se la acido è più forte dello ione ossonio allora l´equilibrio si sposta verso i reagenti e K è molto piccolo, altrimenti viceversa.
dove appunto si è supposta la concentrazione della acqua costante. Da questa relazione non si fà altro che confrontare HA con H3O+ infatti se la acido è più forte dello ione ossonio allora l´equilibrio si sposta verso i reagenti e K è molto piccolo, altrimenti viceversa.
8) Perchè nel calcolo della KW si può considerare la concentrazione della acqua costante:
Perchè essa si dissocia pochissimo, tanto è vero che KW vale 10-14 che per un equilibrio indica che la reazione di dissociazione è tutta spostata verso i reagenti.
9) Cosa si intende per effetto livellante del solvente e come si risolve:
Si intende che non si riesce a creare una priorità tra gli acidi che siano più forti rispetto all´ H3O+ . Il problema si risolve scegliendo quale solvente non la acqua bensì la acido acetico CH3COOH il quale ha una coppia coniugata costituita da una base molto debole la quale ha una minore capacità di attrarre i protoni della acido forte.
Un comportamento analogo si ha anche per la misura della forza di una base quando la base da misurare sia più forte della base OH-.
10) In che categorie si suddividono i composti nei quali sono contenuti uno o più gruppi ossidrilici:
Ossiacidi Þ E´ questo il caso in cui il 3° elemento è elettronegativo al pari della ossigeno quindi quest´ultimo scaricherà la sua elettronegatività nella attrazione verso l´H col quale formerà quindi un legame fortemente ionico che in acqua viene agevolmente attaccato, si dissocia pertanto l´ H+ ed il composto è pertanto un acido. HClO.
Idrossidi Þ È questo il caso in cui il 3° elemento è meno elettronegativo rispetto all´idrogeno pertanto tra l´ossigeno ed il 3° elemento si formerà un legame fortemente ionico che in acqua viene agevolmente attaccato, si dissocia pertanto l´ OH- ed il composto è pertanto una base. KOH.
Anfoliti Þ E´ questo il caso in cui il 3° elemento ha elettronegativà simile a quella della H pertanto L´ossigeno formerà legami ionici con entrambe gli elementi ed a seconda della situazione quindi il composto potrà comportarsi come una base o come un acido.
11) A cosa è legata la forza di un acido:
a) Alla differenza tra il n° di atomi di O ed il n° di atomi di H presenti nel composto, infatti più atomi di O ci sono e con più forza la acido resisterà alla base che gli vuole sottrarre un protone.
b) La forza di un acido diminuisce con il crescere delle dimensioni della atomo centrale le quali a loro volta diminuiscono al crescere del n° di elettroni sull´orbita più esterna. Fatto è che tanto più gli elettroni sono lontani dal nucleo tanto più facilmente possono essere sottratti alla atomo in questione.
c) Negli acidi poliprotici la forza della acido decresce passando dalla prima ionizzazione alla n-esima ionizzazione.
d) Per gli atomi che non contengono ossigeno la forza cresce al crescere delle dimensioni della atomo legato all´H
12) Cosa è il prodotto ionico della acqua:
È la costante legata alla reazione di ionizzazione della acqua KW = [H3O+][OH-] = 10-14 .
13) Cosa è il cologaritmo del prodotto ionico della acqua e cosa indica:
Il cologaritmo è un modo di esprimere i numeri in modo da togliere le potenze negative, pertanto per la acqua pKW = 14, ma la cosa interessante è il fatto che pH + pOH = 14 avendo indicato con pH il cologaritmo della concentrazione degli ioni [H3O+]. Nel caso della acqua pura pH = pOH e la soluzione viene detta neutra.
14) Se il pH è 2,35 quanto vale la concentrazione degli ioni [H3O+] :
[H3O+] = 10 - 2,35
15) Quando una soluzione acquosa è acida e quando basica o alcalina:
Una soluzione è acida quando ha un pH minore di 7 o analogamente un pOH maggiore di 7. Questo perchè un acido in soluzione aumenta la concentrazione degli ioni [H3O+] e pertanto il cologaritmo è più piccolo. La soluzione è invece basica nel caso complementare.
16) Che relazione c´è tra la forza di un acido KA e la forza KB della sua base coniugata:
Il prodotto della costante di dissociazione di un acido e della costante di dissociazione della sua base coniugata è uguale al prodotto ionico della acqua o in generale è uguale al prodotto ionico del solvente. KA * KB = KW .
17) Elencare alcuni acidi forti :
Acido perclorico HClO4 , cloridrico HCl , nitrico HNO3 , solforico H2SO4 , bromidrico Hbr , iodidrico HI, selenico H2SeO4 , HSCN , HIO3
18) Quanto vale il pH di soluzioni acquose di acidi e basi forti con concentrazione > 10-6 :
Si può trascurare la dissociazione della acqua e quindi la concentrazione degli ioni [H3O+] è pari alla concentrazione della acido o , nel caso di una base, la concentrazione degli ioni [OH-] è pari alla concentrazione della base.
19) Quanto vale il pH di soluzioni acquose di acidi e basi forti con concentrazione < 10-6 :
Non si può trascurare la dissociazione della acqua e quindi per un acido la concentrazione degli ioni [H3O+] si ricava dalla:
[H3O+]2 - c [H3O+] - KW = 0.
Nel caso di una base invece la concentrazione degli ioni [OH-] si ricava dalla [OH-]2 - c [OH-] - KW = 0.
20) Quanto vale il pH di una soluzione acquosa di un acido debole:
Occorre trascurare gli ioni [H3O+] provenienti dalla dissociazione della acqua, applicando la legge di azione di massa si giunge alla ![]()
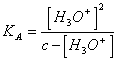 , da questa occorre risolvere la [H3O+]2 + KA * [H3O+] - c * KA = 0 oppure nel caso che KA < 10-3 e c > 10-3 si può trascurare [H3O+] al denominatore ottenendo
, da questa occorre risolvere la [H3O+]2 + KA * [H3O+] - c * KA = 0 oppure nel caso che KA < 10-3 e c > 10-3 si può trascurare [H3O+] al denominatore ottenendo ![]() .
.
21) Quale legge lega il grado di dissociazione a alla concentrazione di un acido debole ed alla concentrazione di [H3O+] :
[H3O+] = c * a
22) Elencare alcuni basi forti :
Gli idrossidi dei metalli alcalini NaOH, KOH, LiOH ed alcalini terrosi Ca(OH)2 , Ba(OH)2 , Sr(OH)2 , etc....
23) Quale legge lega il grado di dissociazione a alla concentrazione di una base debole ed alla concentrazione di [OH-] :
[OH-] = c * a
24) Quanto vale il pH di una soluzione acquosa di una base debole:
Occorre trascurare gli ioni [OH-] provenienti dalla dissociazione della acqua, applicando la legge di azione di massa si giunge alla ![]()
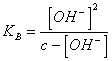 , da questa occorre risolvere la [OH-]2 + KB * [OH-] - c * KB = 0 oppure nel caso che KB < 10-3 e c > 10-3 si può trascurare [OH-] al denominatore ottenendo
, da questa occorre risolvere la [OH-]2 + KB * [OH-] - c * KB = 0 oppure nel caso che KB < 10-3 e c > 10-3 si può trascurare [OH-] al denominatore ottenendo ![]() .
.
25) Come si calcola il pH delle soluzioni di acidi poliprotici:
Il calcolo del pH è molto complesso in quanto occorre tener conto delle successive ionizzazioni però in pratica è fortemente acida solo la 1ª ionizzazione pertanto si può considerare soltanto la concentrazione iniziale di ioni [H3O+].
26) Come si calcolano le concentrazioni degli ioni che prendono origine dalle ionizzazioni successive di un acido poliprotico ?
Occorre ricavarsi le concentrazioni inerenti alla 1ª ionizzazione, osservare che se ci sono ancora H nella acido prodotto, questo tenderà a sua volta a ionizzarsi, pertanto la concentrazione precedentemente trovata non è quella finale ma va ulteriormente decrementata in funzione del grado di dissociazione.
27) Cosa è una soluzione tampone:
È una soluzione che si oppone a brusche variazioni del pH anche se vengono in essa introdotti acidi o basi forti.
28) Quali sono i 3 tipi fondamentali di soluzioni tampone:
a) Soluzione di un acido debole e di un suo sale, per essa vale la ![]()
b) Soluzione di una base debole e di un suo sale, per essa vale la ![]()
c) Miscela di sali di un acido polibasico, per essa vale la
![]()
29) Quali reazioni portano ad uno dei 3 tipi fondamentali di soluzioni tampone:
a) portano al caso di acido debole + un suo sale le reazioni :
*) acido debole(in eccesso) + base forte
*) acido forte + sale di acido debole(in eccesso)
b) portano al caso di base debole + un suo sale le reazioni :
*) base debole(in eccesso) + acido forte
*) base forte + sale di base debole(in eccesso)
c) portano al caso di miscela di sali della acido poliprotico le reazioni :
*) sali acidi poliprotici(in eccesso) + acido forte
*) acidi poliprotici o loro sali(in eccesso) + base forte.
30) Quando una soluzione tampone ha la massima efficienza:
Quando il pH della soluzione è vicino al valore di pKA il che si verifica quando la concentrazione del sale è prossima alla concentrazione della acido o rispettivamente della base.
31) Quanto vale il pH di una soluzione acquosa di un sale derivante da una base forte e da un acido forte:
Vale 7, quanto il pH della acqua, infatti la base forte dà luogo ad un anione che in acqua non reagisce, ed analogamente il catione derivante dalla completa dissociazione della acido forte. Questo tipo di reazione si chiama di neutralizzazione ed al termine ciò che si ottiene è una soluzione di un sale. Il calore ceduto nella neutralizzazione è costante e vale -13680 cal .
32) Quanto vale il pH per un sale derivante da una base forte e da un acido debole:
Il catione derivante dalla base forte non reagisce in acqua mentre la anione derivante dalla acido debole reagisce con la acqua formando ioni OH- e dando pertanto luogo ad una soluzione debolmente alcalina. La costante di ionizzazione dello ione considerato come base debole si ottiene dalla KB = KW / KA e la concentrazione è quella del sale, il pH si può quindi calcolare dalla [OH-]2 + KB * [OH-] - c * KB = 0 .
Il pH della soluzione è però anche calcolabile direttamente tramite la ![]() .
.
È pensabile come la somma di una reazione di neutralizzazione e di una reazione di ionizzazione, al termine delle quali si ottiene un sale di un acido debole ed una base forte.
33) Quanto vale il pH per un sale derivante da una base debole e da un acido forte:
L´anione derivante dall´ acido forte non reagisce in acqua mentre il catione derivante dalla base debole reagisce con la acqua formando ioni H3O+ e dando pertanto luogo ad una soluzione debolmente acida. La costante di ionizzazione dello ione considerato come acido debole si ottiene dalla base relativa tramite la KA = KW / KB e la concentrazione è quella del sale, il pH si può quindi calcolare dalla [H3O+]2 + KA * [H3O+] - c * KA = 0 .
Il pH della soluzione è però anche calcolabile direttamente tramite la ![]() .
.
È pensabile come la somma di una reazione di neutralizzazione e di una reazione di ionizzazione, al termine delle quali si ottiene un sale di una base debole ed un acido forte.
34) Quanto vale il pH di una soluzione acquosa di un sale derivante da una base debole e da un acido debole:
Entrambe gli ioni reagiscono in acqua, si potranno pertanto ottenere soluzioni basiche, acide o neutre in virtù della forza dei rispettivi ioni ed indipendentemente dalla concentrazione del sale. Il pH è determinabile con la :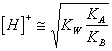 o direttamente
o direttamente ![]() .
.
È pensabile come la somma di una reazione di neutralizzazione e di 2 reazioni di ionizzazione, al termine delle quali si ottiene un sale di acido debole e base debole.
35) Quanto vale il pH di una soluzione acquosa di un sale derivante da un acido derivante dalla ionizzazione di un acido forte poliprotico:
Se la acido è forte la ionizzazione è completa e la acido da essa derivante è un acido debole il cui pH si calcola dalla [H3O+]2 + KA * [H3O+] - c * KA = 0 considerando come KA2 quella relativa alla 2ª ionizzazione della acido forte poliprotico e come concentrazione quella del sale di cui la acido debole è costituente.
36) Quanto vale il pH di una soluzione acquosa di un sale derivante da un acido derivante dalla ionizzazione di un acido debole poliprotico:
Si può avere una soluzione acida, basica o neutra il cui pH è calcolabile tramite la 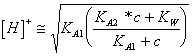
che si può semplificare alla ![]() nel caso che c sia trascurabile rispetto a KA1 e KW trascurabile rispetto a KA2 * c .
nel caso che c sia trascurabile rispetto a KA1 e KW trascurabile rispetto a KA2 * c .
37) Cosa sono gli aminoacidi:
È una categoria di anfoliti che contengono nella stessa molecola il gruppo acido -COOH ed il gruppo basico -NH2 .
38) Cosa è il punto isoelettrico:
È quel valore del pH per il quale la forma protonata e la forma anionica hanno la stessa concentrazione, si ricava dalla :
![]()
39) Cosa si intende per titolazione:
Si intende la determinazione analitica della quantità incognita di una data sostanza facendola reagire in modo completo con una quantità nota di un´altra sostanza detta reattivo titolante.
40) Perchè si utilizza la reazione di neutralizzazione nella titolazione:
Essa soddisfa i seguenti 3 requisiti :
a) È una reazione pressochè completa.
b) Lo stato di equilibrio è raggiunto in breve tempo.
c) La completa reazione è segnalata dal fatto che il n° equivalenti di base = n° equivalenti di acido.
41) Cosa si intende e cosa accade nel punto di equivalenza:
Nel punto di equivalenza il n° di equivalenti di base è uguale al n° di equivalenti di acido, il che vuol dire che si neutralizzano completamente dando luogo ad un sale il cui n° di moli è pari al n° di moli iniziali della sostanza da titolare. A tal punto la acidità o basicità della soluzione è legata unicamente alle caratteristiche di questo sale.
42) Descrivere la titolazione di un acido forte con una base forte:
Al punto di equivalenza si neutralizzano completamente dando luogo ad un sale i cui ioni in acqua non reagiscono e pertanto la soluzione è globalmente neutra, pH = 7 . Non occorre un indicatore particolarmente prossimo a 7 perchè la soluzione non ha proprietà tamponi nè prima nè dopo il punto equivalente pertanto pH=7 è un punto a tangente verticale.
43) Descrivere la titolazione di un acido debole con una base forte :
Al punto di equivalenza si neutralizzano completamente dando luogo ad un sale avente proprietà basiche. Prima che si raggiunga il punto equivalente, la soluzione varia lentamente il suo pH in quanto costituita da un acido debole e da un suo sale, pertanto si comporta come un tampone.
44) Descrivere la titolazione di una base debole con un acido forte :
Al punto di equivalenza si neutralizzano completamente dando luogo ad un sale avente proprietà acide. Prima che si raggiunga il punto equivalente, la soluzione varia lentamente il suo pH in quanto costituita da una base debole e da un suo sale, pertanto si comporta come un tampone.
45) Descrivere la titolazione di un acido diprotico forte con una base forte :
Si ha prima una ionizzazione che determina la perdita del 1° protone della acido, il pH a questo punto è calcolabile come per un qualsiasi acido debole, proseguendo ad introdurre la base si giunge al punto di equivalenza dove acido e base si neutralizzano completamente dando luogo ad un sale avente la caratteristica di una base debole e del quale quindi prima si calcola la KB dalla KA2 indi il pOH ed infine il PH.
46) Descrivere la titolazione di un acido diprotico debole con una base forte :
Si ha prima una ionizzazione che determina la perdita del 1° protone della acido, il pH a questo punto è calcolabile dalla 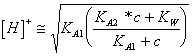 in quanto la acido derivante dalla 1ª dissociazione è un anfolita, proseguendo ad introdurre la base si giunge al punto di equivalenza dove acido e base si neutralizzano completamente dando luogo ad un sale avente la caratteristica di una base debole e del quale quindi prima si calcola la KB dalla KA2 indi il pOH e poi il PH.
in quanto la acido derivante dalla 1ª dissociazione è un anfolita, proseguendo ad introdurre la base si giunge al punto di equivalenza dove acido e base si neutralizzano completamente dando luogo ad un sale avente la caratteristica di una base debole e del quale quindi prima si calcola la KB dalla KA2 indi il pOH e poi il PH.
47) Cosa è un indicatore di pH :
È un acido o base organico debole, avente la caratteristica che la molecola non ionizzata ed il suo ione sono di colore diverso. L´indicatore è caratterizzato da un punto di viraggio in corrispondenza del quale la concentrazione della forma ionizzata della indicatore è pari alla concentrazione della forma non ionizzata. In soluzioni più acide rispetto al punto di viraggio l´indicatore assume il colore della forma non ionizzata mentre in soluzioni basiche esso assume il colore della forma ionizzata, per pH intermedi assume un valore che la colorimetria associa alla combinazione dei colori estremi Un esempio di indicatore è il limone che gettiamo nel thé e ne cambia il colore.
48) Quali molecole sono utilizzate come indicatori di pH e quale principio sfruttano:
Il colore di una sostanza è legata alla sua capacità di assorbire determinate componenti dello spettro della luce e dunque noi vediamo solo lo spettro complementare non assorbito. L´assorbimento della luce è legato alla assorbimento di fotoni quando questi investono un atomo e forniscono la loro energia ad un elettrone facendolo passare ad un livello energetico più elevato. Le molecole aromatiche tipo il benzene grazie alla delocalizzazione degli elettroni presentano una minore distanza tra i livelli energetici e quindi attitudine ad assorbire fotoni proprio dello spettro del visibile.
49) Quale formula lega la differenza tra il pH della soluzione ed il punto di viraggio alle concentrazioni della indicatore non ionizzato e l´indicatore ionizzato:
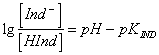 dove pKIND è un valore caratteristico del determinato indicatore.
dove pKIND è un valore caratteristico del determinato indicatore.
50) Quale è il criterio di scelta della indicatore per una determinata soluzione:
Occorre scegliere l´indicatore che abbia un punto di viraggio il più prossimo possibile al valore del pH della soluzione.
51) Descrivere il metodo di titolazione conduttometrico :
È un metodo che per la rilevazione del punto equivalente si basa sulla constatazione che la conducibilità degli ioni H3O+ ed OH- è massima rispetto agli altri ioni, e che nella neutralizzazione in corrispondenza del punto di equivalenza essi raggiungono una concentrazione minima in quanto sostituiti dagli ioni del sale, pertanto al punto equivalente la conducibilità della soluzione è minima.
52) Come si calcola la solubilità per gli idrossidi :
Occorre tener presente che gli idrossidi liberano OH- che si vanno ad aggiungere a quelli della acqua, la solubilità è quindi pari alla sola concentrazione del catione e si può calcolare imponendo che rispetti il prodotto ionico della acqua.
53) Come si calcola la solubilità dei sali provenienti da acidi deboli:
Occorre tener presente che la anione derivante dalla ionizzazione del sale è una base forte pertanto in parte si ricombina con gli H+ della acqua il che equivale a dire che viene sottratta alla soluzione parte della anione, il Ks si sbilancia e quindi dovendo esso rimanere costante, la reazione si sposta verso l´ulteriore scioglimento del sale nella soluzione. In definitiva per tener conto di questo effetto occorre moltiplicare la solubilità s della anione per un fattore correttivo R.
54) Quanto vale il fattore correttivo R per i sali di acidi monoprotici deboli :
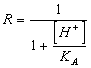 oppure direttamente la solubilità tramite la
oppure direttamente la solubilità tramite la 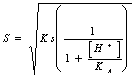
55) Quanto vale il fattore correttivo R per i sali di acidi diprotici deboli ?
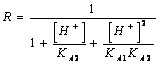 oppure direttamente la solubilità dalla
oppure direttamente la solubilità dalla 
56) Quanto vale il fattore correttivo R per i sali di acidi triprotici deboli :
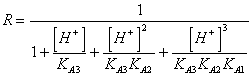
57) Quanto vale la solubilità in acqua di un acido debole poco solubile:
Essa è data dalla somma della concentrazione della acido indissociato e della anione, o , più agevolmente :
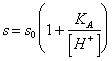 dove s0 è la solubilità della forma indissociata della acido.
dove s0 è la solubilità della forma indissociata della acido.
58) Quanto vale la solubilità in acqua di una base debole poco solubile:
Essa è data dalla somma della concentrazione della base indissociata e del catione, o , più agevolmente :
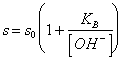 dove s0 è la solubilità della forma indissociata della base.
dove s0 è la solubilità della forma indissociata della base.
59) Quali sono le considerazioni che il metodo Crociani utilizza per il calcolo delle concentrazioni di acidi e basi:
a) Bilancio delle masse tenendo conto che generalmente viene fornita la concentrazione della acido indissociato.
b) Bilancio delle cariche tenendo conto di moltiplicare ogni concentrazione per il n° di cariche del singolo ione.
c) Prodotti di solubilità Ks .
d) Costanti di ionizzazione degli acidi
e) costante Kw
f) in soluzione acida sono trascurabili nelle somme le [OH-] .
g) in soluzione basica sono trascurabili nelle somme le [H3O+] .
h) in soluzioni di acidi poliprotici dove la 1ª ionizzazione è la più sostanziosa, si può trascurare le concentrazioni di acidi delle ionizzazioni successive rispetto alla concentrazione della 1ª ionizzazione.
