Loi d'action de la masse
1) quand une réaction chimique est complète :
Quand pratiquement tout le réactif est scomparso afin de donner l'endroit au produit de la même réaction.
2) que le rapport est entre l'énergie libre DG et l'équilibre d'une réaction chimique :
Indépendamment de la situation il les commence que le système s'étend toujours spontanément pour se tenir à la même composition de l'équilibre, que la valeur minimale de l'énergie libre correspond.
3) combien vaut la peine DG pour une réaction dans l'équilibre :
Il vaut la peine 0 comme pour tous les processus dans l'équilibre.
4) Enounce la loi de l'action de la masse :
Quand une réaction à la température constante rattrape l'équilibre, elle vient a défini une thermodynamique constante de l'équilibre qui dans pratique représente le rendement de la réaction, qui est le rapport entre les produits et les réactifs une fois que la réaction a été arrêtée.

où à elle est l'activité du correspondant de substance à la concentration idéale.
* pour les gaz idéaux = pression
* pour les gaz non idéaux à = f * p où f il est le coefficient d'activité
* pour les liquides pleins et purs l'activité est unitaire.
* pour une solution idéale = concentration.
* pour une solution non idéale à = f * où f il est le coefficient d'activité.
5) Enounce la constante de l'équilibre basée sur la concentration :
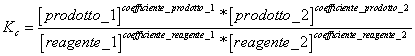
elle vient utilisé dans les réactions qui ont l'endroit dans la phase gazeuse et pour les réactions en solution.
6) dans lequel occasion K * et Kc elles coïncident :
Dans tous ces cas dans lesquels l'activité il coïncide avec la concentration, comme comme exemple pour les gaz qui suivent le comportement idéal (à la basse pression) et pour les solutions diluées beaucoup. C'est de noter que seulement K* est rigoureusement la constante à chaque température peu sensible et aux réactifs et aux produits de déesses de variations de pression.
7) que la constante de l'équilibre qu'elle vient a employé dans les réactions qui intéressent aériforme :
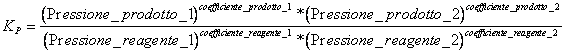
Naturellement les substances doivent être prises en compte seulement qui dans la réaction sont présentées à l'état gazeux.
8) qui alliage K cet K pde relation :
Kp = Kc (droite)Dn où Dn est la différence entre le n° des wharves des produits et le n° des wharves des réactifs
On obtient observer que c = massa/volume = n/V et pour un gaz = P/ droite partiels, remplaçant dans le Kc obtient l'esito.
Dans cette taille de cas de R * K vaut la peine 0.0821 (l * atmosphère/)
9) Enounce la constante de l'équilibre en termes de molaires de fractions :
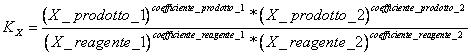
il vient utilisé dans les réactions qui ont l'endroit dans la phase gazeuse et pour les réactions en solution.
10) qui alliage K Xet K Pde relation :
KP = KX * (TOTALde P )Dn où Dn est la différence entre le n° des wharves des produits et le n° des wharves des réactifs
11) dans cette occasion KP, KC, KX coïncide :
Quand la réaction se produit sans changement du n° des wharves des substances gazeuses.
12) que la relation est entre les constantes de l'équilibre et le rendement d'une réaction :
a) si k > > 1 alors la réaction a l'équilibre déplacé vers la droite qui est vers les produits.
b) si k < < 1 alors la réaction a l'équilibre déplacé du côté gauche qui est vers des réactifs.
13) combien vaut la peine la constante de l'équilibre pour la réaction inverse à celle-là considérée :
Il est le mutuel de la constante de calcul de l'equiibrio pour la réaction directe.
14) combien vaut la peine la constante d'équilibre si la réaction pour n est multipliée :
La constante nouvelle de l'équilibre est égale à la vieille constante élevée au n-esima de puissance.
15) combien vaut la peine la constante de l'équilibre pour la somme de réaction de 2 réactions :
C'est le produit des constantes des 2 réactions supplémentaires.
16) Enounce la constante de l'équilibre dans la variation de della de fonction de l'énergie libre au moyen de l'isoterma de relation du fourgon 't Hoff :
DG° = - ln K de R T
là où K peut être un lesquelles des constantes de l'équilibre dans combien la relation coûte seulement valeur à pressuriser et température constante. R s'avère l'égale à 1.98 cal/(K*mole) et DG° s'avérera exprimé en cal/size donc si les wharves intéressés sont plus d'un seront nécessaires pour multiplier DG° pour leur nombre seulement d'une telle manière pourront savoir la variation de l'énergie libre déterminée de la réaction.
17) combien vaut la peine DG° pour la réaction : 2 Cl 2 De NOCl "2PAS :
DG° = 2G°f () G°f (Cl2) - 2G°f (NOCl) et ne pas être G°f (élément dans son norme d'état) = 0 puis
DG° = 2G°f (AUCUN) - 2G°f (NOCl)
18) décrivent l'isocora de relation du fourgon 't Hoff dans la forme les différencie qu'alliage la constante de l'équilibre à la température :
![]()
est observé :
a) si DH0 < 0 la réaction est exothermique et la constante d'équilibre diminue à la croissance de la température.
b) si DH0 = 0 la réaction est le termoneutrale et la constante d'équilibre est indépendant de la température.
c) si DH0 > 0 la réaction est endothermique et la constante d'équilibre devient la croissance de la température.
19) décrivent l'isocora de relation du fourgon 't Hoff dans la forme intégrale qui allient la constante de l'équilibre à la température :
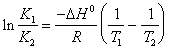
Dans lui R s'avère l'égale à 1.98 cal/(K*mole) et DH° s'avérera exprimé en cal/size.
Pour noter que cette expression est de petits intervalles considérants simples valides de la température, dans qui enferment DH0 il peut considérer comme constant
20) car l'isocora est intégrale transformée de fourgon 't Hoff pour des equilibriums entre est fait d'un système à un membre simple :
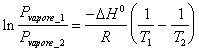
Ceci pourquoi dans les systèmes à un membre simple pde K l'activité est égale à la tension simple de vapeur dans combien pour le liquide coûte unitaire. Analogue pour Kc .
21) combien vaut la peine DH° pour la réaction : 2 Cl 2 De NOCl "2PAS :
DH° = " 2H°f () H°f (Cl2) - 2H°f (NOCl) et ne pas être H°f (élément dans son norme d'état) = 0 puis
DH° = " 2H°f (AUCUN) - 2H°f (NOCl)
22) Enounce le principe du Chatelier ou de l'équilibre mobile :
Quand un changement de le variable est provoqué de l'extérieur (P, T, concentration) d'un système dans l'équilibre, l'équilibre est déplacé un sens qui est opposé à la variation apportée, s'étendant pour diminuer les effets.
23) la chose se produit si elle est essayée d'augmenter la concentration d'un élément dans la réaction :
La constante d'équilibre doit demeurer constante et donc si elle augmente la concentration d'une substance, les autres substances de la réaction changera leur concentration pour faire que la constantedes restes de K c, qui veut indiquer que le système réagit pour consommer l'excès composé.
24) que l'effet a une variation de la pression externe sur un système dans l'équilibre :
Il dépend du type de réaction, comme exemple dans la réaction N2 3H2 " 2NH3 si la réaction procède vers le dx, le n° des wharves diminue, donc si comme exemple il vient augmentait la pression externe sur ce système dans l'équilibre, il essayera de répondre pour décommander cette augmentation de pression, qu'il est se déplacer obtenu l'équilibre vers le n° plus petit des wharves, qui est lui demeurera petite pièce de réactif dans combien transforme presque complètement à vous dans les produits de la réaction.
25) quand une transformation chimique indique homogène et si hétérogène :
Quand c'est reatti à vous qui a produit qu'ils sont présents dans une seule phase, hétérogène si les substances dans l'équilibre chimique sont présentes dans 2 ou plus il est fait.
26) comme elles viennent ont influencé les dissosciations gazeux de la pression et de la température :
Elles doivent être exprimées en termes de degré de dissosciation à, qu'il devra changer pour équilibrer telles qui sont les variations température la pression ou, assez du repos pour observer que le dissosciation est une réaction qui se produit avec l'augmentation du n° des wharves et donc il est préféré d'un diminuizione de la pression externe.
On l'observe d'ailleurs cela qui est le dissosciation caractérisé de l'infraction des cravates, il ne peut pas c'être endothermique, qui est avec l'achat de la chaleur de l'atmosphère et est donc préféré d'une augmentation de la température.
27) Enounce en termes d' à wharves pour la réaction : 2 Cl 2 De NOCl "2PAS :
2 NOCl " 2 AUCUN Cl2
n0(1 - à) (n0à ) (n0à)/2
certain d'autres wharves qui étaient présents pour les produits de réaction, disparaissent supplémentaire aux limites déjà actuelles. Si d'autres réactifs étaient présents, la réaction ne pourrait pas être écrite en termes d' à dans combien ignorerait la contribution sur les produits. Le dissosciation a seulement donc le sens pour ces réactions où un scinde composé dans 2 membres ou plus.
28) Enounce dans la réaction a dissocié des limites des wharves : 2 Cl 2 De NOCl "2PAS :
2 NOCl " 2 AUCUN Cl2
n0(NOCl) - 2x n0(PAS) 2x n0(Cl2) x
29) comme estimer si on donné la réaction est dans l'équilibre et, s'il il n'est pas, dans lequel le sens passe spontanément :
Le D le ln Qde G = de D G° droite est estimé. Les cas suivants peuvent être présentés :
DG = 0 dans tels cas la réaction est dans l'équilibre.
DG < 0 que la réaction passe spontanément du sx vers le dx.
DG > 0 que la réaction passe spontanément du dx vers le sx.
Dans ce dernier cas un calcul certain des wharves visionne préalablement que les wharves qu'ils diminuent concernant la situation les commencent sont ceux des membres qui se trouvent au dx dans la réaction, alors que les membres au sx augmentent le n° des wharves.
30) dans les equilibriums dans lesquels les gaz apparaissent le solide et, que c'est l'importance des wharves de les pleins :
Les wharves de les pleins qui sont consommés sont dans le rapport stoechiométrique exact avec les valeurs des wharves qui sont créés qui doit mais être obtenu par les constantes d'équilibre. Comme exemple dans le calcul des wharves se monte pour le kc, ils vont a seulement considéré les wharves des gaz.
31) comme ils viennent ont influencé les equilibriums des systèmes et des liquides pleins des modifications de la pression ou de la température :
La pression a des minimum d'effets dans combien dans ces réactions coûte insuffisant les variations de volume.
32) en tant qu'un peut être la réaction de velocizzare :
Si c'est nécessité réversible lui-même soyez enlevé les produits de réaction comme formes lui-même, d'une telle manière que le processus se produit de la manière accomplit presque.
33) pendant qu'elles viennent il influencent les equilibriums hétérogènes à vous des variations de la température ou de pression :
Il y a des réactions pour lesquelles étant les liquides, le solide et le gaz actuels, il est immédiat pour comprendre dans quel sens la réaction est effectué avec l'augmentation de volume, la réaction s'avérera stimulé dans un tel sens si la pression externe diminue.
C'est intuitivo comme exemple pour penser que si la pression est augmentée, l'arranger-réaction essayera de diminuer sa pression et donc l'équilibre sera sfavorire déplacé la création de gaz concernant les liquides pleins ou.
34) que le particularitity a l'equilibrio le NH4HS(s) " NH3 (s) H2S(G)
Le réactif en est trouvé à l'à semi-conducteurs donc n'apparaît pas en KC par lequel enK P ni l'un ni l'autre dans un certain calcul certain des wharves PV = n droite, celle il n'a seulement le sens pour les membres à l'état gazeux.
35) pour l'équilibre SnO2 2 H2(G) " le Sn(s) 2 2Hou(g) en tant que 5 wharves de Sn peuvent être obtenus :
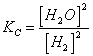 Célèbre doit être fait oui que [ H2 ] est tel que les wharves de H2 sont 10 qui est la double quantité
des wharves de l'étang.
Célèbre doit être fait oui que [ H2 ] est tel que les wharves de H2 sont 10 qui est la double quantité
des wharves de l'étang.
36) pour l'équilibre C(s) Hou2(g) " Co(G) H2 (g) combien eau me coûte nécessaire pour des wharves du gasare 1.1 de C(s) :
1.1 wharves de Co et 1.1 wharves de ou 2 doivent être créés , de sorte que cela arrive dve au desumere les wharves à l'équilibre du KP et à ces derniers pour additionner 1.1.
37) pourquoi si le lasci ouvrait l'eau minérale ce sgasa :
Si la bouteille est écluse il y a de Co2 entre l'eau et le taquet qui a une pression déterminée, si nous ouvrons la bouteille, sorties de cetteCo 2 et la pression à laquelle elle est subalterne la solution est beaucoup le plus bas celle, donc Co 2sous la forme du bollicine qui entrent vers le haut dans la surface, dans la tentative vaine d'une partie de la solution sera produit pour répondre à cette variation des extrémités de système donc que nel.giro.di 10 minuteren le sgasa de l'eau complètement.
