Solutions
1) ce qui est une solution :
C'est un système homogène formé de 2 membres ou plus qui se trouvent dispersés dans le système sous la forme ionienne de molécule ou. E moléculaire fondamental 'que les particules ont des dimensions, autrement sont parlées au sujet de l'état colloïdal.
2) vous elles peuvent être les cravates chimiques entre les substances actuelles dans la solution :
Pas, autrement elle serait soit une question d'un neuf composé. Il doit donc être possible au riottenere de la solution les substances composantes au moyen de procédures physiques de séparation.
3) la chose caractérise et quel ¨ la concentration d'une solution :
Elle caractérise la composition et elle est définie comme la quantité de chaque membre actuel dans un donné à la masse ou au volume de la solution.
4) qui mesurent l'unité a la concentration :
Fait rapport au poids :
pour des centaines dans le g de peso du corps dissous dans 100g de solution
wharves de n° de du molalità m de corps dissous dans 1000g de dissolvant
Wharves de n° de du molare X de fraction des totaux de wharves de member/n° de la solution
Fait rapport au volume :
Pour des centaines dans le g de volume du corps dissous dans le mililiter 100 de la solution
N° de de Molarità M des wharves du corps dissous dans 1000ml de solution
N° de de Normalità N des équivalents du corps dissous dans 1000ml de solution
![]()
Pour des centaines dans le mililiter de de volume du corps dissous dans 100ml de solution le total de volume de la solution n'est pas égal à la somme des volumes des 2 membres mais du subordonné.
5) que le rapport est entre Normalità et Molarità :
![]() où à lui est entier qu'il vaut la peine 1 pour des
acides de monoprotici, 2 pour les acides de diprotici... et le cos¬
par l'intermédiaire de.
où à lui est entier qu'il vaut la peine 1 pour des
acides de monoprotici, 2 pour les acides de diprotici... et le cos¬
par l'intermédiaire de.
C'est le même coefficient qui allient le P.M. et le Peq.
6) quand une solution est elle sature :
Quand dans lui l'indisciolto du corps dissous un est dans l'équilibre avec le disciolto du corps dissous un.
7) quand une solution est soprasatura, et sa stabilité :
Une solution est soprasatura lorsque pour elle que une concentration avançée en corps dissous de au correspondant de concentration à la solution est attrapée vers le haut de sature. Il n'est pas stable, s'étire toujours à attrapent vers le haut la concentration de la solution sature.
8) ce qui est la solubilité :
Pour un a déterminé la substance dans des données dissolvantes à une donnée à la température la solubilité qu'elle correspond à la concentration de la solution sature à cette température, celle est à combien corps dissous un ce coûte disciolto trouvé dans le dissolvant pour cette solution particulière dans laquelle le dissolvant ne peut pas disciogliersi ulteriorly.
9) ce qui est le produit de solubilité :
Il est simplement loi de action de le masse rapporté à réaction de ionisation de corps dissous KS = [ à ][B-]/[ ab ] et le siccome ne devrait pas être parlé au sujet des concentrations mais d'activité, il réalise une partie qui [ ab ] doit être unitaire et donc
KS = [ au ][B-] = constante.
10) combien vaut la peine la solubilité de les sait Pb(IO3)2 fondus dans l'eau :
Ionizza2de Pb(IO 3) en ayantla concentration s et 3 2IO en Pb2- avoir la concentration 2s.
Ks = [ Pb2 ][IO3-]2 = s * (2 s)2 = 4 s3
11) que c'est les formes d'affinchè de condition de les précipitées :
Dans un moment de données le produit [ au ][B-] il doit être > du Ks, qui devant être constant il impose que la réaction est déplacée vers le corps dissous un à l'à semi-conducteurs.
12) décrivent l'effet du terrain communal d'ione :
La solubilité d'un corps dissous un dans l'eau pure davantage est élevée concernant le cas dans lequel même le corps dissous un son est disciolto dans une solution aqueuse contenant l'ione. Afin de la calculer il est nécessaire de considérer dans le produit de solubilité que la concentration de l'ione dans l'issue davantage est élevée tandis que Ks doit rester constant donc dans le complexe créera peu de quntità de l'ione non commun qu'il est équivalent pour indiquer que cela est fondu moins de corps dissous.
13) si j'ai un corps dissous un sur le fond d'une solution, que c'est l'affinchè de condition est fondu tous :
Ce doit être la solubilité égale au rapport entre le n° des wharves et le volume de la solution, en fait la solubilité est la concentration de la solution dans laquelle le corps dissous un est fondu.
14) comme calculer la concentration de la ionienne dans la solution quand l'un des 2 est dans l'excès fort concernant l'autre :
Il doit considérer que l'ione actuel avec une plus petite concentration il tombe tous si [ au ][B-] > Ks, la concentration de l'ione supérieur obtient détourner la quantité de l'autre ione qu'il tombe tandis que la quantité de l'autre ione qu'il reste en solution des gains du Ks. Dans pratique l'effet de l'ione est nécessaire pour maintenir dans le terrain communal d'esprit.
15) comme calculer la concentration de la ionienne en solution quand ils sont dans le rapport stoechiométrique exact :
La solution peut être considérée négliger l'effet de l'ione commun et le considérer donc pendant qu'elle les connaît disciolto dans l'eau pure.
16) ce qui est la signification pour la précipitation de partie aliquote :
La situation convient pour ce qu'un même un ione peut déterminer la précipitation du divers corps dissous 2 ceux, dans un tel cas, le 1° pour tomber il est celui-là pour lequel une plus petite concentration de ce terrain communal d'ione est exigée un.
17) ce qui est le coefficient de division :
Quand un corps dissous un est placé au contact avec 2
dissolvants non miscibles, ripartisce entre d'eux formant 2 ont
distingué des solutions. Le coefficient de division exprime
exactement que le rapport entre la concentration du corps dissous un
dans le dissolvant avec et la concentration du corps dissous un dans
le dissolvant de B est constant. 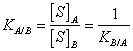
![]()
18) combien de grammes de dissolvant demeurent en solution à la suite de l'extraction avec des litres de V de dissolvant :
![]()
19) en tant qu'un peut être extrait à partir de la quantité dissolvante de corps dissous de plus grand, en utilisant les petits litres de selon dissolvant qui pas dans le cas de la question précédente :
L'extraction peut être effectuée consécutivement plus de périodes avec des quantités égales du dissolvant 2°, dans un tel cas
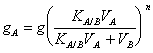
20) Enounce la loi d'Henry sur la solubilité des gaz dans les liquides :
Elle affirme que la solubilité d'un gaz dans un liquide est proporziona ils à la pression partielle du gaz dans l'équilibre avec la solution, à condition que le gaz ne réagit pas avec lui.
21) ce qui est le coefficient de solubilité :
Il exprime combien de gaz il est fondu en volume liquide
et est indépendant de la pression ![]() .
.
22) ce qui est le coefficient d'absorption :
Il exprime combien de gaz est fondu en volume unitaire à
la température t quand la pression du gaz dans l'équilibre avec la
solution est égale à 1 atmosphère ![]() où VG0 est le volume
apporté de nouveau aux conditions de la température de 1 atmosphère
et de 0 K à travers
où VG0 est le volume
apporté de nouveau aux conditions de la température de 1 atmosphère
et de 0 K à travers ![]() .
.
23) que la relation est entre le coefficient de l'absorption à et du coefficient b de solubilité :
![]() là où T0 = 273K
là où T0 = 273K
24) de cette façon la nature du dissolvant et du corps dissous un agit sur la solubilité :
Le processus d'un point de vue thermo-dynamique dans 3 doit être analysé est fait :
a) Venez les molécules séparées du soluto(endotermico).
b) Venez les molécules séparées du solvente(endotermico).
c) Venez les cravates de formes à vous entre les molécules du corps dissous et le solvente(esotermico)
Le budget énergique de ces 3 est fait implique la solubilité différente, en particulier des données de corps dissous sont fondues dans les dissolvants dont les molécules sont des domaines jointifs du même type d'intermolecolari(forze de cravates de van der Waals et présent dipolaire de moments) en corps dissous le pur.
25) ce qui est la solution entalpy et à ce qui elle sert :
L'énergie intérieure PV est la variation (H =) de l'associé entalpy au processus de la création de la solution. Il est utile afin de déterminer si la solubilité de solution de cette date augmente ou diminue avec la température, dans le fattispecie, les augmentations de la température si le processus est endothermique (H > 0), diminue si le processus est exothermique (H < 0).
26) que l'effet a la pression sur la solubilité :
Augmentant la pression le volume diminue et donc il grimpe par conséquent jusqu'à la concentration et à la solubilité.
27) à ce qu'il sert et cette solution idéale caractéristique a un :
Domestiques pour étudier les nombreux phénomènes qui intéressent le processus de solution. Ses caractéristiques sont :
) le volume de la solution il est égal à la somme des volumes des membres.
b) la formation de la solution à partir des membres n'est pas accompagnée du développement ou de l'absorption de la chaleur.
28) ce qui est et ce qui sont la propriété colligative des solutions idéales :
Elles sont propriété qui dépendent seulement du nombre de particules de corps dissous contenu dans l'unité du volume de solution et donc complètement indépendant des chimies de propriété des membres. Elles sont :
a) Quand dans le liquide vient le disciolto un corps dissous un, la tension de vapeur vient modifié.
b) abaissement de crioscopico
c) altitude d'ebulloscopico.
d) pression d'osmotica.
29) ce qui est la tension de vapeur et comme elle vient modifié selon la suite de l'introduction du corps dissous un dans le dissolvant :
La tension de vapeur est la pression pour laquelle le liquide est dans l'équilibre avec de la sa vapeur à l'une température déterminée, il qu'est indique juste la pression qui concurrence à la vapeur, se rappeler qu'un liquide coexiste avec de la sa vapeur au cours d'un passage d'état, la transformation pour laquelle les restes de pression constants pour un donné la température.
Si j'insère un dissolvant non soluble, il distacca donc à un donné la température n'a pas l'équilibre pour une pression et donc la tension inférieure de vapeur.
30) Enounce la loi de Raoult :
L'abaissement relatif de la tension de vapeur du dissolvant est égal à la molaire de fraction du corps dissous un
![]() Valide seulement si le corps dissous un est une
substance non volatile le même concept en d'autres termes :
Valide seulement si le corps dissous un est une
substance non volatile le même concept en d'autres termes :
La tension de vapeur d'une solution idéale donnée des membres à et du B est égale à la somme des produits des tensions de vapeur des membres simples à l'état pur pour la molaire respective de fraction dans la solution.
P = P0 * X À P0B * À XB
Si la tension de vapeur d'un corps dissous un, comme exemple B, est négligeable à la température considérée alors
P = P0 * À XÀ
31) dans le calcul de l'abaissement de la tension de vapeur comme compte de dissosciation le degré est maintenu :
![]()
32) comme composition de la phase est vapeur estimée dans des molaires de fractions :
Pour le membre simple c'est le rapport entre sa pression de vapeur dans le mélange et la pression du total de vapeur du même mélange.
33) si j'ai un mélange liquide dans l'équilibre avec de la sa vapeur, que la cravate de relations les 2 sont fait :
) la pression de vapeur du membre simple dans la vapeur il est égal à la tension de vapeur du membre à l'état pur pour sa molaire de fraction.
b) le n° des wharves du membre simple dans la vapeur elle peut être gagnée du PV = nRT considérant la pression qui concurrence à l'élément simple et qui il est obtenu en point).
34) ce qui est la fusion ou glace le point :
C'est la température à laquelle les tensions de vapeur de les liquides et pleines ont la même valeur.
Nous avons puisque la tension de vapeur de la solution est inférieure à la tension de vapeur du dissolvant à l'état pur et donc si cette tension de vapeur diminue, alors que la tension de vapeur du solide alors l'équilibre entre la constante de deux de vapeur restes de tensions doit nécessairement se produire pour une plus basse température.
35) décrivent le phénomène de l'abaissement de crioscopico :
Glace le point de la solution concernant glace le point du dissolvant pur est abaissé. Crde D = Crde K * molalità
36) expliquent pourquoi il est jeté les sait sur les routes de montagne dans les périodes d'hiver :
Il sait qu'elles sont vous caractérise du fait qui est dissocie complètement à vous, donc dans le cas minimal (comme exemple un NaCl) le facteur du fourgon 't Hoff est égal à 2. qui signifie ce CRde D = CRde K * molalità * 2, donc ne fait pas autre que pour abaisser le seuil auquel l'eau il gèle, évitant d'une telle manière le givrage.
37) ce qui est le point de l'ébullition d'un liquide :
C'est la température à laquelle la tension de vapeur du liquide égale la pression externe.
Nous avons vu que la solution de della de tension de vapeur est alla inférieur vapor tension del allo que dissolvant soit pur et donc si les diminutions de cette tension de vapeur il est l'une température plus élevée nécessaire afin d'égaler la pression externe.
38) décrivent le phénomène de l'altitude d'ebulloscopico :
Le point de l'ébullition de la solution concernant glace le point du dissolvant pur est augmenté. Deb = Keb * molalità
39) expliquent pourquoi, quand il est jeté de les sait dans l'eau qui bouillonne, ceci semble se calmer :
Il sait qu'ils sont vous caractérise du fait qui est dissocie complètement à vous, donc dans le cas minimal (comme exemple un NaCl) le facteur du fourgon 't Hoff est égal à 2. qui signifie ce Deb = Keb * molalità * 2, donc ne fait pas autre qui pour soulever TEBOLLIZIONE .
40) ce qui est une membrane semipermeabile :
Il est un mur qui laisse au passage aux molécules dissolvantes mais ceux du corps dissous ne concourant pas à la mesure de la pression d'osmotica de cet s'exercer.
41) que quel ¨ la pression d'osmotica :
C'est la tendance des molécules du corps dissous s'augmentant en tout le volume de dissolvant à la disposition.
Son expression est semblable à celui-là des gaz idéaux p V = n R T où n il est le n° des wharves du corps dissous tandis que p, changer de V et de T de cette formule qui est l'osmotica P p = à tube cathodique se rapporte au soluzione. Est possible également où c = n/V.
42) à ce que le fait a eu que la pression d'osmotica est exprimée avec une loi semblable à celui-là de gaz idéaux :
Elle mesurent de la manière de la toute la tendance analogue des molécules dissolvantes d'augmenter en tout le volume de solution à eux disposition.
43) que le rapport est entre la pression p d'osmotica et l'inégalité dans une branche d'un tube à U :
p = h (centimètre) * densité (g/cm3) * 981 (dinez) =........ dine/cm2 = [ (.......... dine/cm2 )/1,013*106 ] les atmosphères
44) que une solution de HNO3 dans l'eau, il est considère le binomial du fourgon 't Hoff :
Il est nécessaire de le considérer dans le cas nous sont donnés le relati de propriété vous à n'importe quel colligativa, dans combien HNO3 ce coûte un acide fort et donc complètement dissocié, donc le facteur pour lequel ils vont a multiplié toute la propriété colligative n'est pas en valeur 1 mais 2 et ne peut pas donc être omis.
45) combien vaut la peine la pression d'osmotica pour une solution de 2BaCl et KCl :
p = CTOT * R * T
là où CTOT = C(BaCl2) * I (BaCl2) C(KCl) * I (KCl) = C(BaCl2) * 3 C(KCl) * 2
46) quand 2 solutions sont isotoniche :
Quand elles ont la même pression d'osmotica.
