Dissosciation et électrolyse d'Elettrolitica
1) pour lequel les solutions la propriété colligative assument de diverses valeurs de ces théoriciens :
Pour les solutions du corps dissous qui sont dissociées, qui les savent, les bases et les acides, que les énonciations viennent des électrolytes. Le phénomène a exactement doit le fait que la dissociation d'un élément augmente le n° des particules actuelles en solution et donc ils doivent augmenter également les valeurs de la propriété colligative qui directement sont reliées au n° des particules.
2) que c'est la cause du dissosciation de le ionien de l'électrolyte dans l'eau :
Il y a 2 causes :
) le diélectrique plus grand constant de l'eau a un 80 fois concernant les vides, et le siccome ceci est inversement proporziona qu'elles à l'énergie les améliore de 2 ouvriers électriques localisés chargés à une distance r, suit que l'énergie nécessaire afin d'interrompre la cravate quand c'est dans l'eau il est remarkablly subordonné concernant la force qui serait nécessaire si la cravate étaient dans la vide.
b) la solvatisation implique cela autour aux formes de chaque ione un nuage de molécule d'eau qui expose la partie négative de leur dipöle, cela est l'oxygène, leur attraction est telle pour interrompre la cravate qui dans l'eau a la personne faible devenue et pour créer de ionien le solvata un à vous.
3) ce qui est la signification avec du Na de formule * 5H2ou :
On convient qu'un ione de sodio est solvatato eu, cela est hydraté avec 5 molécules d'eau.
4) comme validité des formules pour la propriété colligative est reconstitué :
Il est nécessaire de les attacher au degré d'ionisation
leur étant multiplié pour le binomial du fourgon 't Hoff ![]() où v sont le n° des wharves de ionien qu'ils forment l'" taille du corps dissous.
où v sont le n° des wharves de ionien qu'ils forment l'" taille du corps dissous.
5) que quel ¨ la dilution d'une solution :
Quand on est dans les beaucoup d'et le stà fortement un indique qu'on est des concentrés à vous tandis que quand est dans au loin peu et le stà, on indique qu'il a été devenu a dilué.
6) Enounce la loi de la dilution d'Ostwald en terms di concentration et degré de dissosciation :
![]() Constante = d'ionisation à une donnée la température.
Constante = d'ionisation à une donnée la température.
7) comme a changé la constante de l'ionisation avec la concentration :
La constante d'ionisation est exprimée en termes de concentration, alors que la véritable constante thermo-dynamique est exprimée en termes d'activité. Les 2 constantes coïncident seulement pour des solutions ont beaucoup dilué ceci pourquoi quand la concentration augmente, la ionienne est trouvée comme dedans par l'intermédiaire de du cours dimanche, qui est font la difficulté pour se déplacer. Cette propriété est estrinsecata par le coefficient f d'activité qu'exactement il diminue avec la concentration pour par l'intermédiaire de des attractions électrostatiques réduites.
8) ce qui est la force ionique :
C'est une mesure de la densité des charges avec la solution et donc avec les actions électrostatiques qui un ione de données est subalterne d'une partie de tous les autres.
![]()
9) que la relation est entre le coefficient f d'activité et la force ionique m :
Pour des solutions caractérisées de la même force ionique, le coefficient d'activité est toujours le même indépendamment de la nature d'autres électrolytes actuels.
10) que le rapport est entre la dilution d'une solution et le degré d'ionisation :
De la loi d'Ostwald on l'observe que si les diminutions de
c, comme exemple en raison d'une augmentation de volume, devant
demeurer K constant pour une donnée la température, alors ![]() doivent se développer, et ceci est obtenue qui augmente le
degré de dissosciation.
doivent se développer, et ceci est obtenue qui augmente le
degré de dissosciation.
11) ce qui est la solubilité d'une substance dans des données dissolvantes :
Le phénomène que la solubilité signifie pour décrire est le fait qui jette l'idrolitina dans l'eau et il ne se fond pas complètement mais lui reste un corps inférieur et l'eau-idrolitina de solution est dite sature.
Elle est définie comme le nombre de wharves de substance qui sont fondus en litre de solution, celui est la molaire de concentration de la solution sature.
12) ce qui est le produit de la solubilité d'un petit électrolyte soluble :
Il est obtenu à partir de Kc appliqué à l'équilibre d'une solution d'un petit électrolyte soluble dans l'équilibre avec sa solution sature. Il est important pourquoi quand le produit des concentrations des anions et du cationi dépasse la valeur de la forme de produit de solubilité de l'un péché précipité quand les concentrations ne vérifient pas le produit de solubilité.
Beaucoup le plus petit est la valeur du produit de solubilité que beaucoup moins le soluble est les sait dans l'issue.
13) pendant qu'il peut calculer la solubilité de les sait :
La réaction de dissosciation est prise et la concentration est placée de les sait égaux à s, fà de dopodichè le produit de solubilité se multipliant pour s le coefficient stoechiométrique de l'un ione respectif, la telle manière est obtenue à sX et ce peut être s gagné par le x-esima de racine du produit de la solubilité divisé à.
14) ce qui est l'effet du terrain communal d'ione :
C'est le diminuizione ultérieur de la solubilité d'un petit électrolyte soluble (que lui est petit fondu) à la suite de l'insertion dans la solution d'une de ionienne venir de ceux du dissosciation du même électrolyte. Cela est expliqué avec le fait que la réaction s'avère justement consommer tout l'autre ione et donc elle sera plus grand précipitée produit.
15) pendant qu'il peut être augmenté la solubilité des données les sait, qui comme exemple la pierre à chaux des machines à laver :
Il est nécessaire de faciliter la réaction détournant les produits, cela elle ne se produit pas avec de petites brucelles mais avec des acides et les bases opportunes qui sont arrangés avec ioniennes les simples et dans une telle manière créez les substances qui afin de donner le sens à tous ne doivent pas être à l'à semi-conducteurs.
16) que le rapport est entre la solubilité et la température :
Le même rapport qu'il y a entre n'importe quel équilibre et la température, qui pour la note déplace l'équilibre vers des réactifs, les sait donc pas disciolto, est fondu augmentant partiellement la température.
17) ce qui est l'ouvrier électrique courant :
C'est un écoulement rangé des frais aux lesquels pu² avant qu'ayez l'endroit dans des conducteurs et des deuxièmes espèces. Dans d'abord lui est dû au mouvement des électrons, dans deuxièmes est à la place dû au mouvement de le ionien.
18) qui è le mécanisme pour lequel le passage du courant dans les conducteurs des espèces 1ª est eu :
Les conducteurs des espèces 1ª sont les métaux et les liquides et dedans ils le courant est transportés exclusivement des électrons. Un tel comportement très est défini de la cravate métallique qui un bonnet de positi ionien de prévisions à vous et autour ils un nuage d'électron.
19) qui è le mécanisme pour lequel le passage du courant dans les conducteurs des espèces 2ª est eu :
Les conducteurs des espèces 2ª sont les savent le solide et les liquides et les solutions d'électrolyte, dont constituées est les savent, bases ou disciolti d'acides dans acqua. le mouvement rangé sont produits à la suite de l'application d'une différence potentielle ils ouvrier électrique, dans 3 sont faits :
) le générateur elle détourne des électrons à un elettrodo(anodo) et elle les fournit à l'altro(catodo) donc que l'anode est chargée franchement tandis que la cathode est chargée négativement.
b) la cathode attire le positi ionien vous qu'ils sont vous forme vous du dissosciation de l'électrolyte de corps dissous dans l'eau, tel que ionien le positi à vous vient cationi d'appels à vous, autour au ce de cathode sera un grand nombre.
l'anode attire ionien nié vous qu'elles sont vous forme vous du dissosciation de l'électrolyte de corps dissous dans l'eau, telle ionienne niée à vous vient des anions d'appels à vous, autour au ce d'anode sera un grand nombre.
c) Nous devons entrer en contact avec 2 distributions des frais qui sont attirés, mais nous du transfert du courant ne peuvent pas être le passage dans combien ouvrier électrique de modalità coûte divers dans les 2 conducteurs, ceci entre à la place dans combien est établi des réactions de la solution de riduzione(la acquiert des électrons) à la cathode et de la solution d'ossidazione(la cédez les électrons) à l'anode.
20) ce qui est une cathode :
C'est l'électrode ou la feuille métallique aux mises à niveau elles négatives vers quel migrano le cationi actuel en solution.
21) ce qui est la résistance d'un conducteur :
C'est le facteur qui allient l'effet qui est l'ouvrier électrique courant à la cause qui est la différence potentielle ils, il qu'il est caractéristique de chaque divers matériaux, et est attaché à sa section, à sa longueur et à son resistività les deuxièmes 2ª la loi de l'ohm :
![]()
22) ce qui est la constante pour une cellule d'elettrolitica :
C'est ![]() le rapport qui sont exactement une
constante pour une cellule d'elettrolitica et mesure en centimètre-1.
le rapport qui sont exactement une
constante pour une cellule d'elettrolitica et mesure en centimètre-1.
23) ce qui est la conductibilité de K d'un conducteur :
Il est l'inverse de la résistance et indique que combien exactement un conducteur coûte prêtez à être croisé de l'ouvrier électrique courant
![]() là où c est
l'inverse du resistività et s'appelle conductivité ou la
conductivité spécifique.
là où c est
l'inverse du resistività et s'appelle conductivité ou la
conductivité spécifique.
24) qui sont les facteurs qui influencent la conductibilité de K d'une solution :
La conductibilité sûre est attachée au n° du cationi et des anions actuels dans l'eau, et ceci que nous avons vue se développe avec la dilution qui est avec le volume. Alors elle est attachée à la mobilité de ionienne.
25) combien vaut la peine la conductibilité de K de 2 processus de la conduction qui se produisent parallèle :
C'est la somme des conductances des processus simples.
26) la conductivité spécifique c d'une solution aqueuse est influencée de la conductivité spécifique c de l'eau :
Dans combien le c de l'eau ne coûte pas beaucoup de terre en contre-bas, toutefois pour des mesures de précision extrême a détourné le và il au c mesuré.
27) ce qui est le poids équivalent pour un électrolyte :
C'est le rapport entre son poids moléculaire et le produit du n° des wharves du cationi qui sont formés pour le n° des charges positives associées à chaque taille, comme exemple pour Cu(SO4) prenant comme Cu 2de référence nous ont ce PE = PM/(1*2). Tels évaluent identique si est calculé concernant l'anion (CONNAÎT4)2 .
28) ce qui est la constante de Faraday :
C'est total positif ou le négatif de charges qui peuvent être obtenus à partir du dissosciation complet de 1 g-équivalent de l'n'importe quel électrolyte, il est égal au produit du n° d'Avogadro pour des charges avec l'électron simple. ? et = F.
1 Faraday = 96487 Coulombs = 26.8 Ampèreheure
29) ce qui est la conductivité équivalente L:
Il se propose pour attacher la conductibilité d'une
solution à sa ![]() concentration où N est une
normalité qui est égale au produit du molarità pour le n° des frais
de l'ione. Es : H2 est nécessaire pour multiplier pour 2 le molarità.
concentration où N est une
normalité qui est égale au produit du molarità pour le n° des frais
de l'ione. Es : H2 est nécessaire pour multiplier pour 2 le molarità.
Il vient défini comme la conductibilité de ce volume de la solution qui contient le disciolto 1 équivalent d'électrolyte, mesuré entre 2 parallèles d'électrodes à la distance de 1 centimètre.
30) ce qui est la limite L ¥ de conductivitééquivalente :
On l'observe que pour des solutions personnes faibles, également augmentant la dilution, n'a pas plus d'augmentation de la conductivité équivalente, donc la valeur maximum de rattrapé lui vient limite définie, c'est legs au fait que l'augmentation de la dilution est augmentée également le dissosciation jusqu'à ce qu'à la valeur maximum = à 1 qu'elle correspond L¥ exactement soit donc utile pourquoi il désaccouple la conductivité de la concentration et donc il reste seulement attaché à la mobilité de l'ione.
31) que le rapport est entre la conductivité équivalente et la limite de conductivité équivalente :
![]()
32) Enounce la loi de la dilution d'Ostwald en termes de L et L¥ :
![]()
33) Enounce la loi de Kohlraush :
Chaque ione qu'il contribue dans la mesure caractéristique et constante à la limite de conductivité équivalente d'un électrolyte, et sa contribution est indépendante de la nature de venir de l'autre ione du dissosciation de l'électrolyte.
![]()
34) pourquoi L¥ (H 3ou) d'ED ionien (OH- ) dans l'eau beaucoup plus est respect élevé à autre ionien :
La conductivité élevée n'est pas due à la mobilité particulière de ionienne mais du fait que dans l'eau ils forment et créent dans la continuité un grand nombre de cravates OH sous l'infuence d'un champ électrique, donc les mouvements de protons d'une molécule d'autre attraper vers le haut de l'électrode opportune.
35) ce qui est électrolyse :
C'est le phénomène pour lequel une transformation chimique d'une solution au moyen d'ossidoriduzioni est eue quand ceci est croisé de l'ouvrier électrique courant. Le phénomène a doit se déchargeant des présents ioniens en solution sur l'électrode respective. La quantité de substance est attachée à la quantité de l'électricité qui croise la solution et à l'équivalent de poids de la substance considérée.
36) origine de l'électrolyse nommée :
Lisi = infraction, convient donc l'infraction des cravates pour par l'intermédiaire de l'ouvrier électrique.
37) relation entre la batterie et l'électrolyse :
Elles sont 2 processus complémentaires, le 1° il est spontané et il a la portée à produire à l'énergie électrique à travers des réactions d'ossidoriduzione, alors que le 2° il n'est pas spontané et nécessité de l'énergie assurée à partir d'une batterie afin de réaliser des réactions de l'ossidoriduzione au but pour séparer aux substances aux présents purs d'état en solution comme ionien.
38) en cours d'électrolyse que l'électrode est la cathode, que l'anode et celle il les améliore ayez-les :
La cathode est pour la définition l'électrode où la réduction se produit et donc la substance à l'état pur est formée, pour s'avérer justement la réduction, des électrons des demandes fournir à la solution que cette fois est fourni à partir de la batterie et donc la cathode est l'électrode plus négative. Le pôle positif de la batterie s'est relié à l'anode d'électrode, du ciuccia par l'intermédiaire des électrons concourant donc la formation du positi ionien à vous qu'ils obtiennent débarrassés dans l'eau, et sont allés recombiner sur la cathode avec venir des électrons de la batterie.
39) ayant en solution n croisillons ossidoriduttive, qu'il sera déchargé à l'anode :
Se rappeler cela à l'anode que l'oxydation se produit, le croisillon d'ossidoriduttiva sera oxydé en ayant des mises à niveau elles elettrodico plus de fond tandis qu'à la cathode se produire la réduction, déchargera avoir le croisillon les améliore elettrodico plus positif.
40) il est possible d'obtenir la décomposition des métaux alkalins et du terrosi alkalin dans les solutions aqueuses :
Pas, dans combien elles ont des mises à niveau elles subordonné d'elettrodico concernant le croisillon H3ou / H2 et donc il est ceci au ridursi.
41) Enounce les 2 lois de Faraday sur l'électrolyse :
) les quantités de substances qui sont formées aux électrodes elles sont proporziona elles à la quantité de l'électricité qui a croisé la solution.
b) les poids de 2 diverses substances produites à partir de la même quantité de l'électricité sont proporziona elles aux équivalents de poids des mêmes substances.
42) Enounce la formule de Faraday afin de gagner la quantité de substance a produit par l'électrolyse :
![]() là où F est la constante de Faraday, le poids
équivalent comme pour l'ossidoriduzioni est dividende estimé que le
poids moléculaire de la substance pour le n° des électrons échange
à vous. En termes de wharves la proportion peut à la place
être installée :
là où F est la constante de Faraday, le poids
équivalent comme pour l'ossidoriduzioni est dividende estimé que le
poids moléculaire de la substance pour le n° des électrons échange
à vous. En termes de wharves la proportion peut à la place
être installée :
1 Faraday : 1 mole = x_moli Q :
en fait 1 Faraday est la quantité de charges associées à une taille d'électron.
43) Estrinsecare les conséquences du passage du courant dans une solution :
La cathode d'Al se produit la réduction avec la formation des substances que l'allo ne soit pas ionique, les électrons d'affinchà d'approvisionnements de générateur qui se produit, anode d'alla se produit le della de nel d'oxydation de course que les électrons viennent Al rapporté produisant de la fermeture d'une telle manière le circuit.
44) ce qui est la signification pour le rendu de faradico :
La quantité de substance produite dans pratique est inférieure concernant cela qui calcule pour par l'intermédiaire de de l'insturarsi des nombreux processus de l'ossidoriduzione, entre lesquels se déchargeant de H ionien3ou donc il vient a défini un rendu de faradico de l'électrolyse
![]() équivalent au rendu courant
équivalent au rendu courant
![]()
45) ce qui est des mises à niveau ils de la décomposition d'une solution :
C'est des mises à niveau elles etD au delà dont la solution a une proportionnalité dirigée entre la différence potentielle a appliqué eux et l'intensité du courant qui croise la solution. Avant qu'il vient a attrapé vers le haut ceci les améliore à la croissance de la tension appliquée que le courant augmente de la manière insignifiante.
46) Enounce la loi de l'ohm pour les conducteurs des espèces 2ª :
![]()
47) auquel cause le phénomène décrit est legs des mises à niveau elles de la décomposition :
C'est la somme de 2 facteurs ;
) dès qu'ils commenceront la réduction et l'oxydation, on produit d'une une batterie intérieure à la solution qui est opposée au fem l'externe comme dedans un circuit de potenziometrico, grimpant jusqu'à la tension externe que le fem de la batterie intérieure se développe de la manière spéculaire jusqu'à l'atteinte à une valeur etledit R les améliore le réversible dont de l'ionisation, au delà la batterie externe a le côté au vent.
b) le processus dans la vérité n'est pas réversible et les processus qui composent l'électrolyse doivent arriver à la vitesse adaptée, si un d'eux est plus lent, deviennent une surtension nécessaire cette des compensations cette étape lente.
48) pendant qu'on l'estime il les améliore de la décomposition pour une donnée la cellule d'elettrolitica :
EtD = EtANODO - EtCATHODE
là où et l'ANODE est des mises à niveau associées leur à la réaction d'oxydation qui arrive à l'anode qui est celle-là aux mises à niveau inférieures elles de Nernst entre tous. Et la CATHODE est à la place des mises à niveau associées leur à la réaction de réduction qui arrive à la cathode qui est celle-là aux mises à niveau elles de plus haut Nernst entre tous.
savoir de 49) que le surmenage de la décharge de l'hydrogène sur le nickel vaut la peine 0,21v déterminant la réaction et elle les améliore à associé il :
2 H3Ou 2e ® H2 (g) 2 H2Ou

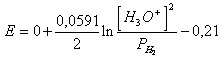
savoir de 50) que le surmenage de l'oxygène sur le platine vaut la peine 0,48v déterminant la réaction et elle les améliore à associé il :
6 H2O ® Ou2 (g) 4 H3Ou 4e
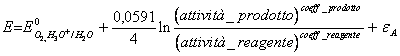
![]()
51) dont des processus sont produit au cours de l'électrolyse :
) nouveau ionien en solution qu'ils doivent répandre dans serré de l'anode afin de remplacer ceux qui sont déchargés.
b) le ionien dans la vérité est solvata à vous et est donc nécessaire de l'énergie additionnelle afin de les déshydrater.
c) le ionien qui est décharge à vous doit se joindre afin de créer un cristal stable, cela il exige l'énergie.
d) Si la substance produite pour la réduction est à l'état de gaz, ceci doit être séparé de l'anode.
52) ce qui est un voltametro à argenter :
C'est un instrument en position à mesurer la quantité de l'électricité qui croise un circuit de données simplement en utilisant la loi de Faraday qui mesure les montants de substance qu'ils sont déposés sur la cathode. Il est constitué à partir de deux électrodes argentées plongées dans une solution d'Ag(NO)3 .
