Acides et bases
1) ce qui est un acide :
Un n'importe quelles espèces chimiques capables pour rapporter un proton (ione H) à une base.
2) ce qui est une base :
Un n'importe quelles espèces chimiques capables accepter le proton a rapportées d'un acide.
3) ce qui est la signification pour le croisillon conjugué :
On convient qu'un acide pour la perte du proton est transformé dans une base et de la manière analogue la base pour l'achat d'un proton est transformée dans un acide. Le croisillon conjugué donc est constitué à partir d'un acide conjugué et d'une base conjuguée.
4) ce qui est la signification pour la substance d'anfolita :
Une substance comme l'eau convient ou l'ammoniaque qui peut réagir est comme les acides qui comme des bases.
5) ce qui est la signification par la force d'un acide :
La force d'un acide est une mesure de sa capacité de rapporter un proton.
6) la chose par la force convient d'une base :
La force d'une base est une mesure de sa capacité d'attacher un proton.
7) comme la mesure la force d'un acide concernant celui-là d'un autre acide :
Un croisillon est nécessaire pour fixer une référence
qui est à base d'acide sous la forme dissolvante, normalement l'eau
et pour calculer la constante de l'ionisation 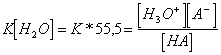 de la
réaction où exactement la concentration de l'eau constante a été
supposée. De ce fà de relation autre que le confronter A avec
H3ou en fait
si l'acide est plus fortement d'ossonio d'ione puis l'équilibre n'est
pas déplacé vers les réactifs et le K est beaucoup petit, autrement
viceversa.
de la
réaction où exactement la concentration de l'eau constante a été
supposée. De ce fà de relation autre que le confronter A avec
H3ou en fait
si l'acide est plus fortement d'ossonio d'ione puis l'équilibre n'est
pas déplacé vers les réactifs et le K est beaucoup petit, autrement
viceversa.
8) pourquoi dans le calcul du KW la concentration de l'eau constante peut être considérée :
Pourquoi elle dissocie mineurs, est beaucoup vrai que KW vaille la peine 10-14 que pour un équilibre il indique que la réaction de dissosciation est tout déplacée vers des réactifs.
9) ce qui est la signification pour le pouvoir égalisant du dissolvant et car on le résout :
On convient qu'il n'est pas réussi pour créer une priorité entre les acides qui sont plus forts concernant H3ou . Le problème est le choix résolu que le dissolvant l'eau mais l'acide acétique ch3COOH que qui a un croisillon conjugué a constitué à partir d'une personne beaucoup faible de base n'ont pas une plus petite capacité d'attirer des protons de forte acide.
Un comportement analogue est eu également pour la mesure de la force d'une base quand la base à la mesure est plus fortement de la base OH-.
10) dans celui les catégories subdivisent les composés dans lesquels sont contenus un ou plusieurs groupes d'ossidrilici :
Le E fortement ionique d'Ossiacidi 'ceci le cas dans quel 3° le bout un d'élément est elettronegativo au pair de l'oxygène donc ceci déchargera son elettronegatività dans l'attraction vers le H avec lequel elle formera donc une cravate qui dans l'eau vient facilement attaqué, dissocie donc H et le composé est donc un acide. HClO.
Le d'Idrossidi est ceci le cas dans quel 3° l'élément il est moins d'elettronegativo concernant l'hydrogène donc entre l'oxygène et 3° l'élément formera une cravate fortement ionique qui dans l'eau vient facilement attaqué, dissocie donc l'OH- et le composé est donc une base. KOH.
Le E d'Anfoliti 'ceci le cas dans quel 3° l'oxygène d'élément a l'elettronegativà semblable à celui-là du H donc formera les cravates ioniques avec les les deux les éléments et à la deuxième de la situation donc que la base composée pourra être comporté comme une ou un acide.
11) à ce que la force d'un acide est attachée :
) à la différence entre le n° des atomes de ou et le n° des atomes actuels de H dans le composé, en fait plus d'atomes qu'ou sont et avec plus de force l'acide résistera à la base qu'il qu'il veut détourner un proton.
b) la force d'un acide diminue avec la croissance des dimensions de l'atome les centre que ce qu'elles chronomètrent diminue à la croissance du n° des électrons sur l'orbite plus externe. Le fait est que beaucoup plus d'électrons sont loin du noyau beaucoup plus facile peuvent être détournés à l'atome dans l'issue.
c) En acides de poliprotici la force de l'acide diminue le dépassement du premier n-esima d'ionisation à l'ionisation.
d) Pour les atomes qui ne contiennent pas l'oxygène la force devient la croissance des dimensions du legs d'atome au H
12) ce qui est le produit ionique de l'eau :
C'est la constante attachée à la réaction de l'ionisation de l'acqua le KW = [ H3ou ][OH-] = 10-14 .
13) ce qui est le cologaritmo du produit ionique de l'eau et ce qui indique :
Le cologaritmo c'est une manière d'exprimer les nombres pour couper les puissances négatives, donc pour le pK de l'eauW = 14, mais intéresser ce qui est le fait que le pH a indiqué le pOH = 14 ayant avec le pH le cologaritmo de la concentration de ionien [ H3ou ]. Dans le cas de l'eau pure pH = pOH et la solution il vient ledit neutre.
14) si le pH combien coûte 2.35 vaut la peine la concentration de ionien [ H3ou ] :
[ H3Ou ] = 10 - 2.35
15) quand une solution aqueuse est acida et si de base ou alkalin :
Une solution est acida quand elle a un pH plus petit de 7 ou analogue un pOH plus grand de 7. Ce pourquoi un acide en solution augmente la concentration de ionien [ H3ou ] et donc le cologaritmo est plus petit. La solution est à la place de base dans le cas complémentaire.
16) que la relation est entre la force de l'acido un Kà et la force KB de sa base conjuguée :
Le produit de la constante du dissosciation d'un acide et de la constante du dissosciation de sa base conjuguée est égal au produit ionique de l'eau ou d'une façon généralisée il est égal au produit ionique du dissolvant. K * À KB = KW.
17) détaillent quelques acides forts :
HClO acide perchlorique4 , hydrochlorate HCl, HNO nitrique3 , H sulfurique2je CONNAIS4 , bromidrico Hbr, l'iodidrico HI, le selenico H2SeO4 , HSCN, HIO3
18) combien vaut la peine le pH des solutions aqueuses des acides et des bases fortes avec la concentration > 10-6 :
Le dissosciation de l'eau peut être négligé et donc la concentration de ionien [ H3ou ] est égale à la concentration de l'acide ou, dans le cas d'une base, à la concentration de ionien [ l'OH-] il est égale à la concentration de la base.
19) combien vaut la peine le pH des solutions aqueuses des acides et des bases fortes avec la concentration < 10-6 :
Le dissosciation de l'eau ne peut pas être négligé et donc pour un acide la concentration de ionien [ H3ou ] est gagnée de :
[ H3ou ]- c [ 2 H3ou ] - KW = 0.
Dans le cas d'une base à la place la concentration [ l'OH -]de l'OH ionien est le dalla gagné [-]- 2 C [ OH-] - KW = 0.
20) combien vaut la peine le pH d'un la solution aqueuse d'une personne faible acide :
Il doit nécessaire négliger ionien [ H3ouvenir de ] du dissosciation de l'eau, appliquant la loi de l'action
de la masse soyez ![]()
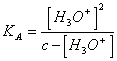 atteint, de ceci il doit
nécessaire résoudre [ H3ou ]2 K * [ H3ou ] - c * KA = 0 ou dans le cas ces 10K <-3 la communauté européenne > 10-3 H 3 ou ]au dénominateur
peut être négligé [ obtenant
atteint, de ceci il doit
nécessaire résoudre [ H3ou ]2 K * [ H3ou ] - c * KA = 0 ou dans le cas ces 10K <-3 la communauté européenne > 10-3 H 3 ou ]au dénominateur
peut être négligé [ obtenant ![]() .
.
21) dont alliage de loi le degré de dissosciation à à la concentration d'une personne faible acide et à la concentration [ H3ou ] :
[ H3ou ] = c * à
22) détaillent quelques bases fortes :
L'idrossidi des métaux alkalins NacOh, KOH, LiOH et terrosi alkalin Ca(OH)2 , Ba(OH)2 , 2Sr(OH) , etc......
23) dont alliage de loi le degré de dissosciation à à la concentration d'une personne faible basse et à la concentration [ l'OH-] :
[ l'OH-] = c * à
24) combien vaut la peine le pH d'un la solution aqueuse d'une personne faible basse :
Il est nécessaire de négliger [ l'OH -]venir ionien de du dissosciation de
l'eau, l'application de la loi de l'action de la masse est atteinte ![]()
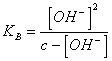 au, de ceci il est nécessaire de résoudre [ l'OH-]2 KB * [ l'OH-] - c * KB = 0 ou dans le cas que K10 B <-3 la communauté européenne > 10-3 peut être négligé [ OH-] à l'obtention de dénominateur
au, de ceci il est nécessaire de résoudre [ l'OH-]2 KB * [ l'OH-] - c * KB = 0 ou dans le cas que K10 B <-3 la communauté européenne > 10-3 peut être négligé [ OH-] à l'obtention de dénominateur ![]() .
.
25) comme pH est estimé des solutions acides de poliprotici :
Le calcul du pH est beaucoup complexe dans combien coûte nécessaire pour tenir le compte des ionisations successives mais dans pratique c'est fortement l'acida seulement 1ª le pu² d'ionisation donc pour considérer seulement la concentration les commence de ionien [ H3ou ].
26) pendant que les concentrations de les ioniennes sont estimées qui prennent l'origine des ionisations successives d'un acide de poliprotico ?
Il est nécessaire de gagner les concentrations inhérentes à 1ª l'ionisation, pour observer que si est H immobile en acide produit, ceci s'étendra à son tour à l'ionizzarsi, donc la concentration précédemment trouvée n'est pas que l'extrémité mais elle va ulteriorly decrementata en fonction du degré de dissosciation.
27) ce qui est une garniture de solution :
C'est une solution qui est opposée aux variations brusques du pH même si venu dans lui a présenté les acides ou les bases forts.
28) qui sont les 3 types fondamentaux de garniture de solutions :
) solution d'une personne faible acide et son elle les
sait, parce que elle vaut la peine la La ![]()
b) La solution d'une personne faible basse
et son les sait, parce que elle vaut la peine la La ![]()
c) Le mélange de les sait d'un acide de polibasico, parce que il vaut la peine la La
![]()
29) que les réactions portent à un des 3 types fondamentaux de garniture de solutions :
) elles portent au cas acide la personne que faible sa les sait les réactions :
*) base forte acide d'excès de debole(in)
*) l'acide fort les connaît de l'excès acide de debole(in)
b) ils portent à la situation de base la personne que faible sa les sait les réactions :
*) acide fort bas d'excès de debole(in)
*) la base forte les connaît de l'excès bas de debole(in)
c) porte à la caisse de mélange de les sait de l'acide de poliprotico les réactions :
*) les sait acide fort d'excès de poliprotici(in d'acides)
*) acides ou eux de poliprotici base forte d'excès de sali(in).
30) quand une garniture de solution a l'efficacité maximum :
Quand le pH de la solution il est près de la valeur du pK à cette vérification quand la concentration de les sait est à côté de la concentration d'acide ou de respectif de la base.
31) combien vaut la peine le pH d'une solution aqueuse de les sait dérivant d'une base forte et d'un acide fort :
Il vaut la peine 7, combien le pH de l'eau, en fait la base forte donne à endroit à un anion qui dans l'eau ne réagit pas, et analogue le catione dérivant du dissosciation complet de l'acide fort. Ce type de réaction s'appelle de la neutralisation et à la limite que cela est obtenu est une solution d'un les sait. La chaleur rapportée dans la neutralisation est constante et vaut la peine -13680 calories.
32) combien vaut la peine le pH pour les sait dérivant d'une base forte et d'une personne faible acide :
Le catione dérivant de la base fortement ne réagit pas dans l'eau tandis que l'anion dérivant de la personne faible acide réagit avec de l'eau formant l'OH ionien- et donnant donc à l'endroit à une faiblement solution alkaline. La constante considérée de l'ionisation de l'ione en tant que personne faible basse obtient à partir du KB = K avec du Kà et la concentration est qu'un de les sait, le bidon de pH donc soit calculée à partir [ l'OH-]de 2 KB * [ l'OH-] - c * KB = 0.
Le pH de la solution elle est mais également calculable
directement à travers ![]() .
.
Elle est thinkable comme somme d'une réaction de neutralisation et une réaction d'ionisation, à la limite di.le qu'elle est obtenu les sait d'une personne faible acide et d'une base forte.
33) combien vaut la peine le pH pour les sait dérivant d'une personne faible basse et d'un acide fort :
L'anion dérivant de l'acide fortement ne réagit pas dans l'eau tandis que le catione dérivant de la personne faible basse réagit avec de l'eau formant H ionien3ou et donnant donc à l'endroit à un acida de solution faiblement. La constante considérée de l'ionisation de l'ione en tant que personne faible acide obtient à partir de la base relative par le K = K avec du KB et la concentration est qu'un de les sait, le pH qu'il peut donc calculer à partir [ H3ou ]de 2 K * [ H3ou ] - c * KA = 0.
Le pH de la solution elle est mais également calculable
directement à travers ![]() .
.
Elle est thinkable comme somme d'une réaction de neutralisation et une réaction d'ionisation, à la limite di.le qu'elle est obtenu les sait d'une personne faible basse et d'un acide fort.
34) combien vaut la peine le pH d'une solution aqueuse de les sait dérivant d'une personne faible basse et d'une personne faible acide :
Des les deux ioniens réagissent dans l'eau, pourront donc
être les solutions basiques obtenues, acide ou le neutre dans la
vertu de la force de vous respect à vous ionien et indépendamment de
la concentration d'elle les sait. Le pH il est déterminable
avec :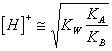 ou directement
ou directement ![]() .
.
Il est thinkable comme somme d'une réaction de neutralisation et 2 réactions d'ionisation, à la limite di.le qu'elle est obtenu les sait de la personne faible acide et de la personne faible de base.
35) combien vaut la peine le pH d'une solution aqueuse de les sait dérivant d'un acide dérivant de l'ionisation fortement d'un acide de poliprotico :
Si l'acide est fortement l'ionisation qu'il est complet et l'acide de le dériver est une personne faible acide dont le pH on estime l'à partir [ H3ou ]de 2 K * [ H3ou ] - c * KA = 0 considérant comme KA2 que le parent un à 2ª l'ionisation fortement de l'acide de poliprotico et comme concentration celui-là de les sait de quelle personne faible acide il est constitutif.
36) combien vaut la peine le pH d'une solution aqueuse de les sait dérivant d'un acide dérivant de l'ionisation d'une personne faible de poliprotico acide :
Un acida de solution, un de base ou le neutre peuvent
être eus par dont le pH il est calculable 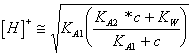
qu'il peut être devenu plus simple ![]() au dans le cas que c est négligeable concernant KA1 et KW négligeable concernant le *cde K A2.
au dans le cas que c est négligeable concernant KA1 et KW négligeable concernant le *cde K A2.
37) ce qui est les acides aminés :
C'est une catégorie d'anfoliti qu'ils contiennent dans la même molécule l'acide de groupe - COOH et le groupe de base - NH2 .
38) ce qui est isoélectriquement le point :
C'est cette valeur du pH pour lequel la forme de protonata et la forme anionique ont la même concentration, il est gagné de :
![]()
39) ce qui est la signification pour le tiration :
La détermination convient l'analytics incognito de la quantité d'une donnée le sostanza la faisant pour réagir de la manière complète avec une quantité célèbre d'un autre réactif de titolante de préceptes de substance.
40) pourquoi la réaction de la neutralisation dans le tiration est employée :
Elle répond à l'exigence 3 suivante :
) la réaction presque complète est une.
b) l'état d'équilibre est pris dans le temps court.
c) la réaction complète est marquée du fait ce n° les équivalents des équivalents d'acide de base = de n°.
41) ce qui est la signification et ce qui se produit dans le point d'équivalence :
Dans le point d'équivalence le n° des équivalents bas il est égal au n° des équivalents acides, celui qu'il veut indiquer qu'ils sont neutralisés donnant complètement l'endroit les sait à qui n° des wharves il est égal au n° des wharves les commence de la substance du support. À un tel point l'acidité ou la basicité de la solution est attachée aux caractéristiques de ceci les sait seulement.
42) décrivent le tiration d'un acide fort avec une base forte :
Au point d'équivalence qu'ils sont neutralisés donnant complètement l'endroit les sait à qui ionien dans l'eau elles ne réagissent pas et donc la solution est totalement neutre, pH = les 7. Il n'est pas nécessaire un indicateur particulièrement prochain de 7 pourquoi la solution n'a pas des garnitures de propriété ni l'un ni l'autre avant que ni l'un ni l'autre après le point équivalent donc pH=7 ne soit un point à la tangente verticale.
43) décrivent le tiration d'une personne faible acide avec une base forte :
Au point d'équivalence qu'ils sont neutralisés donnant complètement l'endroit à sait les avoir propriété de base. Avant que le point équivalent est rattrapé, la solution diverse lentement son pH dans combien constitué à partir d'une personne faible acide et son les connaît, donc est comportée comme une garniture.
44) décrivent le tiration d'une personne faible basse avec de l'acide fort :
Au point d'équivalence qu'ils sont neutralisés donnant complètement l'endroit à sait les avoir acide de propriété. Avant que le point équivalent est rattrapé, la solution diverse lentement son pH dans combien constitué à partir d'une personne faible basse et son les connaît, donc est comportée comme une garniture.
45) décrivent le tiration d'un acide de diprotico fortement avec une base forte :
Une ionisation est eue avant qui détermine la perte de 1° le proton de l'acide, le pH au point de questo est calculable quant à l'n'importe quelle personne faible acide, continuant à présenter la base il est atteinte le point d'équivalence où l'acide et la base sont neutralisés donnant complètement l'endroit pour savoir les avoir la caractéristique d'une personne faible basse et quel donc avant que soient estimés le KB du Kindien A2 le pOH et finalement le pH.
46) décrivent le tiration d'une personne faible acide de diprotico avec une base forte :
Une ionisation est eue avant qui détermine la perte de 1°
le proton de l'acide, le pH au point de questo qu'il est calculable de 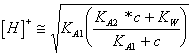 dans combien la dérivation acide de 1ª le
dissosciation coûte anfolita, continuant à présenter la base il est
atteint le point d'équivalence où l'acide et la base sont
neutralisés donnant complètement l'endroit pour savoir les avoir la
caractéristique d'une personne faible basse et quel donc avant que
soient estimés le KB du Kindien A2 le
pOH et puis le pH.
dans combien la dérivation acide de 1ª le
dissosciation coûte anfolita, continuant à présenter la base il est
atteint le point d'équivalence où l'acide et la base sont
neutralisés donnant complètement l'endroit pour savoir les avoir la
caractéristique d'une personne faible basse et quel donc avant que
soient estimés le KB du Kindien A2 le
pOH et puis le pH.
47) ce qui est un indicateur du pH :
C'est un acide ou une personne faible basse organique, ayant la caractéristique qui la molécule d'ionizzata et son ione ne sont pas de diverse couleur. L'indicateur est caractérisé d'un point de viraggio dans la correspondance de laquelle la concentration de la forme d'ionizzata de l'indicateur est égale à la concentration de l'ionizzata de forme pas. Dans les solutions plus d'acide concernant le point de viraggio l'indicateur assume la couleur de l'ionizzata de forme pas tandis que dans les solutions basiques il assume la couleur de la forme d'ionizzata, parce que intermédiaire de pH qu'elle assume que une valeur que le colorimetria associe à la combinaison des couleurs d'extrémité un exemple d'indicateur est le citron que nous jetons dans le thé et de lui il change la couleur.
48) que des molécules sont employé comme des indicateurs du pH et dont le principe tire profit :
La couleur d'une substance est attachée à sa capacité d'absorber les membres déterminés du fantôme de la lumière et donc nous voyons seulement complémentaire le fantôme non absorbé. L'absorption de la lumière est legs à l'absorption de photon quand ceux-ci investissent un atome et fournissent leur énergie à un électron faisant pour le passer à plus à un niveau énergique élevé. Le type aromatique de molécules que le benzène remercie au delocalizzazione des électrons présentent une plus petite distance entre les niveaux énergiques et donc attitude pour absorber des photons juste du fantôme de l'évident.
49) qui alliage de formule la différence entre le pH de la solution et le point de viraggio aux concentrations de l'ionizzato d'indicateur pas et de l'indicateur d'ionizzato :
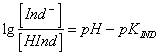 là où le Indde pK est une valeur caractéristique de l'indicateur
déterminé.
là où le Indde pK est une valeur caractéristique de l'indicateur
déterminé.
50) qui il est le critère de choisi de l'indicateur pour un a déterminé la solution :
Il est nécessaire de choisir l'indicateur qu'il a un point de possible le prochain viraggio à la valeur du pH de la solution.
51) décrivent la méthode de tiration de conduttometrico :
C'est une méthode qui pour l'aperçu du point équivalent est basée sur l'évaluation qui la conductivité ionienne de H3ou et de l'OH- elle est maximum concernant l'autre ionien, et que dans la neutralisation dans la correspondance du point d'équivalence ils rattrapent une concentration minimale dans de combien remplacé de le ionien savez-les, donc à l'équivalent de point la conductivité de la solution est minimale.
52) comme solubilité pour l'idrossidi est estimé :
Il est nécessaire de maintenir dans l'esprit que l'idrossidi OH libre- qu'eux sont allés pour ajouter à ceux de l'eau, la solubilité est donc égale à la concentration simple du catione et du pu² à être imposer estimé que vous respectez le produit ionique de l'eau.
53) pendant qu'on l'estime la solubilité de les sait venant de des personnes faibles d'acides :
Il est nécessaire de maintenir dans l'esprit que l'anion dérivant de l'ionisation de sait qu'elles est une base forte donc en partie est recombinées avec H de l'eau qu'elle est équivalente pour indiquer qui vient détourné aux feuilles de solution de l'anion, le Ks est biseautée et donc l'ayant à rester constant, la réaction est déplacée vers l'issolution ultérieur de les sait dans la solution. Après que tout afin de tenir le compte de cet effet il soit nécessaire pour multiplier la solubilité s de l'anion pour le facteur correctif R.
54) combien vaut la peine le facteur correctif R pour les sait des personnes faibles d'acides de monoprotici :
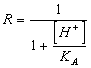 ou directement la solubilité à travers
ou directement la solubilité à travers 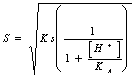
55) pour combien vaut la peine le facteur correctif R les connaît des personnes faibles d'acides de diprotici ?
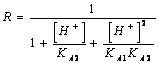 ou directement le dalla de solubilité
ou directement le dalla de solubilité 
56) combien vaut la peine le facteur correctif R pour les connaît des personnes faibles d'acides de triprotici :
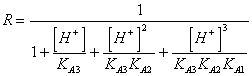
57) combien vaut la peine l'hydrosolubilité d'une petite personne faible soluble acide :
Il est donné de la somme de la concentration de l'acide d'indissociato et de l'anion, ou, plus facilement :
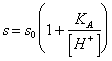 là où s0 sont la
solubilité de la forme d'indissociata de l'acide.
là où s0 sont la
solubilité de la forme d'indissociata de l'acide.
58) combien vaut la peine l'hydrosolubilité d'une petite personne faible soluble basse :
Il est donné de la somme de la concentration de la base d'indissociata et du catione, ou, plus facilement :
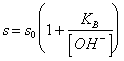 là où s0 sont la
solubilité de la forme d'indissociata de la base.
là où s0 sont la
solubilité de la forme d'indissociata de la base.
59) qui sont les considérations que la méthode de Crociani emploie pour le calcul des concentrations des acides et des bases :
) le budget des masses tenant le compte qui vient généralement a assuré la concentration de l'acide d'indissociato.
b) Budget des frais tenant le compte pour multiplier chaque concentration pour le n° des frais de l'un ione simple.
c) Produit de la solubilité de Ks.
d) Constante de l'ionisation des acides
et) kilowatt constant
f) en solution acida l'OH sont négligeable dans les sommes [-].
g) dans la solution basique elles sont négligeables dans les sommes [ H3ou ].
h) dans les solutions acides de poliprotici où 1ª l'ionisation est le plus substantiel, il peut être négligé les concentrations acides des ionisations successives concernant la concentration de 1ª l'ionisation.
