État aériforme
1) ce qui est la signification pour aériforme :
La limite aériforme de congloga les gaz et les vapeurs, la propriété de l'aériforme sont :
) elle n'en possède pas que vous formez d'elle le volume juste en raison des forces conséquentes insuffisantes de la cravate à la grande énergie cinétique, l'aériforme s'étire donc pour occuper tout l'espace à sa disposition.
b) Tous les mets forment à vous d'aériforme sont homogènes, cela est la propriété physique sont égaux dans chaque point.
intoxiquez aériforme = qui est trouvé à de au-dessus de de la température critique
vapeur aériforme = ce trouvailles à l'une température inférieure à la température critique.
2) de ce qui est la signification pour la température critique et des lesquels sont les causes :
C'en est la température au delà dont aériforme ne peut pas être liquéfiée, est la pression qu'il est subalterne.
Il est dû à la composition des forces suivantes :
a) les forces de la cravate de Van der Waals qui dépendent en solo de la distance entre les molécules et augmente donc avec P
b) la vitesse moyenne de La des molécules diminue avec diminuer de la température, jusqu'à rendre le liquide l'aériforme.
3) ce qui est la signification pour des conditions normales pour un gaz :
Les conditions physiques conviennent : la température = pression égal à 0°C de 273.16 K la = 1 atmosphère.
4) la chose exprime les torr :
La colonne de mercure est la pression exercée d'un (hectogramme) haut 1 milimeter.
5) la chose exprime l'atmosphère :
C'est la pression moyenne d'air au niveau de la mer
6.1) 1 PA = 9.87 * 10-6 atmosphères 6.2) 1 torr = PA 133.3
6.3) 1 atmosphère = 760 torr 6.4) 1 dm3 = 1 litre
7) caractéristiques d'un gaz idéal :
) il est constitué à partir des molécules de punctiform dont le volume est qui est nul.
b) les molécules ne s'exercent pas à une distance entre d'elles une certaine force attrayante ou de repulsiva.
c) les molécules dans les coups entre d'elles et avec le récipient elles sont comportées comme les sphères parfaitement élastiques.
8) Enounce la loi de Boyle pour les gaz idéaux :
Pour un donné à la masse idéale de gaz le volume c'est inversement proporziona ils à la pression à la température constante
![]()
Le diagramme qui le représente est une branche d'hyperbole équilaterale
9) ce qui est la température absolue :
C'est la température non attachée à l'expansion d'une substance particulière mais au comportement de l'n'importe quel gaz, le 0 de la balance de Kelvin il représente en fait la température pour laquelle le volume d'un gaz parfait devrait être décommandé a basé sur la loi suivante de Charles.
10) Enounce la loi de Charles pour les gaz idéaux :
Pour un indiqué la masse idéale de gaz, à la pression constante, le volume est directement proporziona ils à la température absolue.
![]()
Le diagramme qui le représente est un droit.
11) Enounce la loi de Gai-Lussac pour les gaz idéaux :
Pour une donnée la masse idéale de gaz, au volume constant, la pression est directement proporziona ils à la température absolue.
![]()
Le diagramme qui la représente est un droit.
12) Enounce l'équation d'état des gaz idéaux :
C'est une combinaison des lois précédemment décrites
![]()
si fait rapport à une taille simple il vaut la peine P V = n R T
13) combien vaut la peine R dans PV = nRT :
R est constant cependant peut assumer de diverses valeurs à la deuxième de l'unité en laquelle la pression est exprimée :
R = 0.0821 atmosphère * l * mole de -1 * K-1
R = 8.31 kPa * l * mole de -1 * K-1
R = 8.31 J * mole de -1 * K-1
R = 1.99 calories * mole de -1 * K-1
14) ce qui est le facteur de compressibilité :
C'est ![]() le rapport peut assumer les
valeurs suivantes :
le rapport peut assumer les
valeurs suivantes :
< 1 dans un vrai gaz pour de basses températures et pressions.
1 pour les gaz idéaux.
> 1 dans un vrai gaz pour les températures et des pressions élevées.
15) Enounce le principe d'Avogadro :
Les divers volumes égaux de gaz, en mêmes conditions de la température et de pression, contiennent le même un n° des molécules. Le résultat de conglobato est également lui aiment les 3 lois précédentes dans PV = nRT
16) combien vaut la peine le volume d'un n'importe quelle substance gazeuse à c.n. :
22.4 litres pour chaque taille de substance gazeuse.
17) différences entre de vrais gaz et gaz idéaux :
) des molécules ils sont attirés entre d'eux et donc le volume est inférieur concernant celui-là du gaz idéal. Par conséquent le P est somme de la pression du gaz et d'une pression interne.
b) les molécules ont un volume non nul donc que le vrai volume du gaz sont indiqués de la différence entre le volume idéal et le covolume qui est le volume occupé des molécules.
Le modèle du gaz du compte de prises de van der Waals de
ces modifications ![]()
18) si vrais les gaz et les gaz idéaux ont les comportements semblables :
Au pressioni bas dans combien les molécules elles coûtent éloignées entre d'elles et donc des forces attrayantes insuffisantes et aux températures élevées.
19) ce qui est la densité :
C'est le rapport entre la masse d'un gaz et son volume, il est calculable du PV = nRT, infatti d = gr/V
![]()
20) qui alliage de relation la densité de 2 gaz en divers états de pression et de la température :
![]()
21) ce qui est la densité relative :
C'est le rapport de la densité d'un gaz concernant cet un d'un autre, pris comme la référence, mesurant tous les deux la densité dans les mêmes conditions.
![]()
22) décrivent le phénomène du dissosciation gazeux :
Pour quelques substances la densité relative au lieu d'être indépendante de la température diminue à la croissance de la température, ceci a doit le fait que la température influence sur leur dissosciation.
23) ce qui est le degré de dissosciation :
C'est le rapport entre le n° des wharves dissociés et le n° des wharves qu'il les commence. Il change entre 0 et 1.
24) ce qui est la densité théorique et la densité les éprouve et pendant qu'elles sont attachées :
dt = densité de la substance non dissociée
ds = densité de la substance a dissocié avec le degré de dissosciation à
![]()
là où la particule de n est le nombre obtenu de particules "ce elle est dissociée.
25) la molécule calculent n = n° qui prend l'origine du dissosciation d'un dans 3 la réaction2SO " 2SO2 ou2 :
v = 3/2 = 1.5
26) ce qui est la pression partielle :
C'est la pression exercée d'un membre d'un mélange gazeux s'il seul occupait le volume entier à la disposition du mélange, à la même température.
27) ce qui est la molaire de fraction :
C'est le rapport entre le n° des wharves d'un membre et les totaux de wharves du mélange
28) que la relation n'est jamais écrit mais elle est toujours présente dans les exercices sur des mélanges de gaz :
La somme des molaires de fractions des éléments qui constituent un mélange est égale à 1.
29) comme volume partiel d'un gaz de fabrication est la partie estimée d'un mélange :
Le total occupé du mélange pour la fraction est multiplié la molaire de volume du gaz intéressé, de cette valeur peut être atteint le n° des wharves du gaz par PV = nRT.
30) Enounce la loi de Dalton concernant la molaire de fraction et au volume partiel :
La loi de Dalton établit que chaque gaz d'un mélange agit indépendamment d'autres gaz actuels et le total de pression du mélange est la somme du parziali de pressions. P = p1 p2 ... pn .
concernant la molaire de fraction :![]() concernant la pression partielle :
concernant la pression partielle :![]()
31) comme pression d'un gaz s'est rassemblé sur l'eau est estimé :
Elle est égale à la différence entre la pression externe et la tension de vapeur de l'eau pour la température de cette date. D'ailleurs s'il y a une inégalité entre le niveau de l'eau extérieurement et intérieur à la reliure, la pression hydrostatique doit être détournée à la pression externe également.
32) comme pression hydrostatique est estimé :
On l'observe que 1 torr est égal à la pression exercée de la colonne hectogramme élevé un mercure 1mm et dont la densité est 13.6 g/cm3. La proportion avec de l'eau est effectuée dont la densité est 1gr/mm3 et on l'obtient à combien de torr comme exemple correspond une inégalité de l'eau égale à 1 centimètre.
33) Enounce la loi des combinaisons en volume de Lussac gai :
Quand les substances gazeuses réagissent ou elles sont formées dans une réaction, leurs volumes, mesurés en mêmes conditions de la température et de pression, elles sont entre d'elles dans le rapport des nombres entiers et petits.
34) aspects de la théorie cinétique de gaz :
La théorie est développée pour partir de suivre les 4 hypothèses :
) la pression elle est due aux collisions des molécules avec les murs du récipient.
b) les collisions sont élastiques.
c) pas est des forces d'intermolecolari.
d) l'énergie cinétique moyenne est proporziona elles à la température absolue.
Élaborant ces hypothèses et sur la base des considérations cinématographiques l'équation d'état des gaz parfaits est gagnée théoriquement à ce que c'était à la place des joints pour par l'intermédiaire des expériences elles. Un résultat ultérieur est également que ne pas exister une vitesse constante pour des particules du gaz, dans combien la vitesse change dans la suite pour par l'intermédiaire de des coups, existe une vitesse qui est celle-là possédée dans un moment de données du nombre plus grand de particules et dicte la vitesse à la mode.
35) définissent le phénomène de l'effusion :
C'est le passage d'un gaz par un trou dans les conditions en lesquelles le phénomène il n'est pas influencé des coups entre les molécules de gaz.
36) Enounce la loi de Graham sur les vitesses des gaz :
Les vitesses auxquelles les différents gaz diffus sont
inversement proporziona elles aux racines carrées du respect pèse à
vous le molecolari.
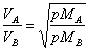
Cette loi est un résultat de la théorie cinétique de gaz.
37) combien vaut la peine le milieu P.M. de poids moléculaire d'un mélange de C62H 6 etde CH6 :
C'est le poids moléculaire moyen qui est estimé qui sommaire des produits des molaires de fractions pour le correspondant P.M..
MÉLANGE de P.M. = cC6H6 * 18 h.CH6 CC2H6 * 14 heuresCH6
38) que la relation est entre le nombre de wharves d'un mélange et le n° des wharves du son les membres :
Le n° des wharves du mélange c'est la somme du n° des wharves des membres.
