Soluciones
1) cul es una solucin:
Es un sistema homogenous formado a partir de 2 o ms miembros que se encuentren dispersados en el sistema bajo forma jnica de la molcula o. E molecular fundamental ' que las partculas tienen dimensiones, si no se habla sobre estado coloidal.
2) usted pueden ser lazos qumicos entre las actuales sustancias en la solucin:
No, si no estara sea una cuestin de un nuevo compuesto. Debe por lo tanto ser posible al riottenere de la solucin las sustancias componentes por medio de procedimientos fsicos de la separacin.
3) la cosa caracteriza y qu la concentracin de una solucin:
Caracteriza la composicin y se define como la cantidad de cada actual miembro en uno dado a la masa o al volumen de la solucin.
4) que mide la unidad tiene la concentracin:
Divulgado al peso:
para los centenares en el Peso g del solute en 100g de la solucin
wharves del molalit m n del solute en 1000g del disolvente
Wharves del molare x n de la fraccin de los totales de los wharves de member/n de la solucin
Divulgado al volumen:
Para los centenares en el volumen g de solute en el mililiter 100 de la solucin
Molarit M n de wharves del solute en 1000ml de la solucin
Normalit N n de equivalentes del solute en 1000ml de la solucin
![]()
Para los centenares en el mililiter del volumen del solute en 100ml de la solucin el total del volumen de la solucin no es igual a la suma de los volmenes de los 2 miembros sino del inferior.
5) que Relazioneship est entre Normalit y Molarit:
![]() donde a l est entero que vale 1 para los cidos del
monoprotici, 2 para los cidos del diprotici... y lechuga romana
va.
donde a l est entero que vale 1 para los cidos del
monoprotici, 2 para los cidos del diprotici... y lechuga romana
va.
Es el mismo coeficiente que alea el P.M. y Peq.
6) cuando es una solucin satura:
Cuando en l el indisciolto del solute uno est en equilibrio con el disciolto del solute uno.
7) cuando una solucin es soprasatura, y su estabilidad:
Una solucin es soprasatura cuando para ella que una concentracin avanzada del solute al correspondiente de la concentracin a la solucin se coge encima de satura. l no es estable, estira siempre a coge para arriba la concentracin de la solucin satura.
8) cul es la solubilidad:
Para uno determin la sustancia en datos disolventes a uno dado a la temperatura la solubilidad que corresponde a la concentracin de la solucin satura a esa temperatura, de que est a cunto solute uno es disciolto encontrado en el disolvente para esa solucin particular en la cual el disolvente no pueda disciogliersi ulteriorly.
9) cul es el producto de la solubilidad:
l es simplemente ley de accin de masa divulgado a reaccin de ionizacin de solute KS = [ al ][B-]/[ AB ] y el siccome no tendra que ser hablado sobre concentraciones sino que de la actividad, alcanza alguno que [ AB ] deba ser unitario y por lo tanto
KS = [ al ][B-] = constante.
10) cunto vale la solubilidad de las sabe Pb(IO3)2 derretidos en agua:
Ionizza2de Pb(IO 3) en tenerconcentracin s y 3 2IO del Pb2- tener concentracin 2s.
Ks = [ Pb2 ][IO3-]2 = s * (2 s)2 = 4 s3
11) que es las formas del affinch de la condicin de la precipitada:
En un momento de los datos el producto [ al ][B-] debe estar > del Ks, que teniendo que ser constante l impone que la reaccin est movida hacia el solute uno al de estado slido.
12) describe el efecto del campo comn del ione:
La solubilidad de un solute uno en agua pura se eleva ms con respecto al caso en el cual igual el solute uno su es disciolto en una solucin acuosa que contiene ione. Para calcularla es necesario considerar en el producto de la solubilidad que la concentracin del ione en la edicin est elevada ms mientras que Ks debe seguir siendo constante por lo tanto en el complejo crear poco quntit del ione no comn que es equivalente decir que eso est derretida menos solute.
13) si tengo un solute uno en el fondo de una solucin, que es el affinch de la condicin se derrite todos:
Debe ser la solubilidad igual al Relazioneship entre n de wharves y el volumen de la solucin, en hecho la solubilidad es la concentracin de la solucin en la cual se derrite el solute uno.
14) como calcular la concentracin las jnicas en la solucin cuando uno de los 2 est en el exceso fuerte con respecto al otro:
Debe ser considerado que baja el ione presente con una concentracin ms pequea l todos si [ al ][B-] > Ks, la concentracin del ione en exceso obtiene desfalcar la cantidad del otro ione que baja mientras que la cantidad del otro ione que permanece en aumentos de la solucin del Ks. En prctico el efecto del ione es necesario tener en cuenta campo comn.
15) como calcular la concentracin las jnicas en la solucin cuando estn en el Relazioneship stoichiometric exacto:
La solucin se puede considerar descuidar el efecto del ione comn y consideracin por lo tanto mientras que los sabe disciolto en agua pura.
16) qu soporte para la precipitacin de la parte alcuota:
La situacin conviene para cul puede determinar un mismo un ione la precipitacin del vario solute 2 unos, en tal caso, el 1 para bajar l es aqul para el cual una concentracin ms pequea de este campo comn del ione se exige uno.
17) cul es el coeficiente de la divisin:
Cuando un solute uno se coloca al contacto con 2
disolventes no miscibles, ripartisce en medio de ellos que formaban 2
distinguieron soluciones. El coeficiente de la divisin expresa
exactamente que el Relazioneship entre la concentracin del solute
uno en el disolvente a y la concentracin del solute uno en el
disolvente de B es constante. 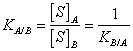
![]()
18) sigue habiendo cuntos gramos del disolvente en la solucin a la continuacin de la extraccin con litros de V de disolvente:
![]()
19) como uno puede ser extrado de la cantidad disolvente del solute de mayor, usando los pequeos litros segn de disolvente que no en el caso de la pregunta anterior:
La extraccin se puede realizar consecutivamente ms pocas con las cantidades iguales del disolvente 2, en tal caso
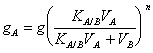
20) declara la ley del Henrio en la solubilidad de gases en los lquidos:
Afirma que la solubilidad de un gas en un lquido es proporziona ellos a la presin parcial del gas en equilibrio con la solucin, a condicin de que el gas no reacciona con l.
21) cul es el coeficiente de la solubilidad:
Expresa cunto gas se derrite en un volumen lquido y es
independiente de la presin ![]() .
.
22) cul es el coeficiente de absorcin:
Expresa cunto gas se derrite en el volumen unitario a la
temperatura t cuando la presin del gas en equilibrio con la
solucin es igual a 1 atmsfera ![]() donde estel volumen V
G 0 trado de nuevo a las condiciones de la
temperatura de 1 atmsfera y de 0 K a travs
donde estel volumen V
G 0 trado de nuevo a las condiciones de la
temperatura de 1 atmsfera y de 0 K a travs ![]() .
.
23) que la relacin est entre el coeficiente de la absorcin a y del coeficiente b de la solubilidad :
![]() donde T0 = 273K
donde T0 = 273K
24) de esa manera la naturaleza del disolvente y del solute uno acta en la solubilidad:
El proceso desde un punto de vista termodinmico en 3 se debe analizar se hace:
a) Vienen las molculas separadas del soluto(endotermico).
b) Vienen las molculas separadas del solvente(endotermico).
c) Vienen los lazos de las formas a usted entre las molculas del solute y el solvente(esotermico)
El presupuesto enrgio de estos 3 se hace implica la diversa solubilidad, en detalle los datos del solute se derriten en los disolventes que molculas son estados unidos del mismo tipo de intermolecolari(forze de los lazos de van der Waals y presente dipolar de los momentos) en solute el puro.
25) cul es la solucin entalpy y a qu sirve:
La energa interna PV es la variacin (H =) del asociado entalpy al proceso de la creacin de la solucin. Es til para determinarse si la solubilidad de esa solucin de la fecha aumenta o disminuye con la temperatura, en el fattispecie, los aumentos de la temperatura si el proceso es endotrmico (H > 0), disminuye si el proceso es exotrmico (H < 0).
26) que el efecto tiene la presin en la solubilidad:
Aumentando la presin el volumen disminuye y por lo tanto por lo tanto aumenta a la concentracin y a la solubilidad.
27) a lo que sirve y esa solucin ideal caracterstica tiene uno:
Criados para estudiar los fenmenos numerosos que interesan el proceso de la solucin. Sus caractersticas son:
a) el volumen de la solucin l es igual a la suma de los volmenes de los miembros.
b) la formacin de la solucin a irse de los miembros no se acompaa del desarrollo o de la absorcin del calor.
28) cul es y cul es la caracterstica colligative de las soluciones ideales:
Son caracterstica que dependen solamente del nmero de la partcula del solute contenido en la unidad del volumen de la solucin y por lo tanto totalmente independiente de las qumicas de la caracterstica de los miembros. Son:
a) Cuando en el lquido viene el disciolto un solute uno, la tensin del vapor viene modificado.
b) el bajar del crioscopico
c) elevacin del ebulloscopico.
d) presin del osmotica.
29) cul es la tensin del vapor y como ella viene modificado a la continuacin de la introduccin del solute uno en el disolvente:
La tensin del vapor es la presin para la cual el lquido est en equilibrio con su vapor a una temperatura determinada, l que indica apenas la presin que compite al vapor, es recordar que un lquido coexiste con su vapor en el curso de un paso del estado, la transformacin para la cual el restos de la presin constante para uno dado temperatura.
Si inserto un disolvente no soluble, distacca por lo tanto a uno dado temperatura no tiene el equilibrio para una presin y por lo tanto una tensin ms baja del vapor.
30) declara la ley de Raoult:
El bajar relativo de la tensin del vapor del disolvente es igual a la muela de la fraccin del solute uno
![]() Vlido solamente si el solute uno es una
sustancia no voltil el mismo concepto en otras palabras:
Vlido solamente si el solute uno es una
sustancia no voltil el mismo concepto en otras palabras:
La tensin del vapor de una solucin ideal dada de los miembros a y del B es igual a la suma de los productos de las tensiones del vapor de los solos miembros al estado puro para la muela respectiva de la fraccin en la solucin.
P = P0 * X A P0B * A XB
Si la tensin del vapor de un solute uno, como ejemplo B, entonces es insignificante a la temperatura considerada
P = P0 * A XA
31) el clculo de bajar de la tensin del vapor como cuenta del dissosciation se mantiene el grado:
![]()
32) como la composicin de la fase es vapor estimado en muelas de las fracciones:
Para el solo miembro es el Relazioneship entre su presin del vapor en la mezcla y la presin del total del vapor de la misma mezcla.
33) si tengo una mezcla lquida en equilibrio con su vapor, que el lazo de Relaziones los 2 se hace:
a) la presin del vapor del solo miembro en el vapor l es igual a la tensin del vapor del miembro al estado puro para su muela de la fraccin.
b) la n de wharves del solo miembro en el vapor puede ser ganada de PV = nRT que considera la presin que compite al solo elemento y que se obtiene en el punto).
34) cul es la fusin o hiela el punto:
Es la temperatura a la cual las tensiones del vapor de la lquida y slida tienen el mismo valor.
Tenemos ya que la tensin del vapor de la solucin es inferior a la tensin del vapor del disolvente al estado puro y por lo tanto si esta tensin del vapor disminuye, mientras que la tensin del vapor del slido entonces el equilibrio entre la constante de dos del vapor restos de las tensiones debe suceder necesariamente para una temperatura ms baja.
35) describe el fenmeno de bajar del crioscopico:
Hiela el punto de la solucin con respecto hiela el punto del disolvente puro se baja. Crde D = crde K * molalit
36) explica porqu se lanza los sabe en los caminos de la montaa en los perodos del invierno:
Sabe que son le caracterizan del hecho que es disocia totalmente a usted, por lo tanto en el caso mnimo (como NaCl del ejemplo) el factor de la furgoneta ' t Hoff es igual a 2. que significa ese CR= el CR de K* molalit de D * 2, por lo tanto no hace otro que para bajar el umbral a el cual el agua l congele, evitando de tal manera la formacin de hielo.
37) cul es el punto de hervir de un lquido:
Es la temperatura a la cual la tensin del vapor del lquido iguala la presin externa.
Hemos visto que la solucin del della de la tensin del vapor es alla inferior que vapor disolvente tension del allo sea puro y por lo tanto si las disminuciones de esta tensin del vapor l son una temperatura ms alta necesaria para igualar la presin externa.
38) describe el fenmeno de la elevacin del ebulloscopico:
El punto de hervir de la solucin con respecto hiela el punto del disolvente puro se levanta. Deb = Keb * molalit
39) explica porqu, cuando se lanza de los sabe en el agua que burbujea, sta se parece calmarse:
Sabe que son le caracterizan del hecho que es disocia totalmente a usted, por lo tanto en el caso mnimo (como NaCl del ejemplo) el factor de la furgoneta ' t Hoff es igual a 2. que significa esa Deb = Keb * molalit * 2, por lo tanto no hace otro que levantar TEBOLLIZIONE .
40) cul es una membrana semipermeabile:
Es una pared que se va al paso a las molculas disolventes solamente las del solute que no concurre a la medida de la presin del osmotica de este ejercitar.
41) que qu la presin del osmotica:
Es la tendencia de las molculas del solute que se amplan en todo el volumen del disolvente a la disposicin.
Su expresin es similar aqul de los gases ideales p V = n R T donde est la n n l de wharves del solute mientras que p, el variar de V y de T de este frmula que sea el osmotica P p = a tubo catdico refiere al soluzione. Tambin donde est posible c = n/V.
42) a lo que ha tenido el hecho que la presin del osmotica est expresada con una ley similar aqul de gases ideales:
Mide de la manera de toda la tendencia anloga de molculas disolventes a ampliarse en todo el volumen de la solucin a ellos disposicin.
43) que Relazioneship est entre la presin p del osmotica y la desigualdad en un rama de un tubo a U:
p = h (centmetro) * densidad (g/cm3) * 981 (cene) =........ dine/cm2 = [ (.......... dine/cm2 )/1,013*106 ] atmsferas
44) que una solucin de HNO3 en agua, es necesario considere el binomial de la furgoneta ' t Hoff:
Es necesario considerarlo en el caso se da nos relati de la caracterstica usted a cualquier colligativa, en cunto HNO3 es un cido fuerte y por lo tanto disociado totalmente, por lo tanto va el factor para el cual l multiplic toda la caracterstica colligative no est digno de 1 pero 2 y no puede por lo tanto ser omitido.
45) cunto vale la presin del osmotica para una solucin de 2BaCl y kCl:
p = CTOT * R * T
donde CTOT = C(BaCl2) * i (BaCl2) C(kCl) * i (kCl) = C(BaCl2) * 3 C(kCl) * 2
46) cuando 2 soluciones son isotoniche:
Cuando tienen la misma presin del osmotica.
