Lösungen
1) was eine Lösung ist:
Es ist ein gebildetes homogenous System von 2 oder mehr Mitgliedern, die zerstreut im System unter ionischer Molekülform sich finden oder. Grundlegendes E ', dem die Partikel molekulares Maße haben, andernfalls über kolloidalen Zustand gesprochen wurden.
2) Sie können sie chemische Riegel zwischen den anwesenden Substanzen in der Lösung sein:
Nicht, andernfalls würde sie ist eine Angelegenheit eines bestandenen Neuen sein. Es muß zum riottenere von der Lösung die Teilsubstanzen mittels der körperlichen Verfahren der Trennung möglich folglich sein.
3) kennzeichnet Sache und welches ¨ die Konzentration von einer Lösung:
Sie kennzeichnet den Aufbau und sie wird wie die Menge jedes anwesenden Mitgliedes in einem definiert, das zur Masse oder zum Volumen der Lösung gegeben wird.
4) messen das, hat Maßeinheit die Konzentration:
Berichtet das Gewicht:
für Hunderte in Peso g des aufgelösten Stoffs in 100g der Lösung
molalità m n° wharves des aufgelösten Stoffs in 1000g des Lösungsmittels
Bruch molare x n° wharves der member/n° wharves Gesamtmengen der Lösung
Berichtet das Volumen:
Für Hunderte in Volumen g des aufgelösten Stoffs in mililiter 100 der Lösung
Molarità M n° von wharves des aufgelösten Stoffs in 1000ml der Lösung
Normalità N n° von Äquivalenten des aufgelösten Stoffs in 1000ml der Lösung
![]()
Für Hunderte im Volumen mililiter des aufgelösten Stoffs in 100ml der Lösung ist die Volumengesamtmenge der Lösung nicht der Summe der Volumen der 2 Mitglieder aber des Untergebenen gleich.
5) daß Verhältnis zwischen Normalità und Molarità ist:
![]() wo zu ihm ein gesamtes ist, dem es 1 für monoprotici
Säuren ist, 2 für diprotici Säuren... und cos¬ über.
wo zu ihm ein gesamtes ist, dem es 1 für monoprotici
Säuren ist, 2 für diprotici Säuren... und cos¬ über.
Es ist der gleiche Koeffizient, das P.M. und Peq legieren.
6) wenn eine Lösung ist, sättigt sie:
Wenn in ihm das aufgelöster Stoff einer indisciolto im Gleichgewicht mit dem aufgelöster Stoff einer disciolto ist.
7) wenn eine Lösung soprasatura und seine Stabilität ist:
Eine Lösung ist soprasatura, wenn für sie, die eine vorgerückte Stoffkonzentration zu des Konzentration Korrespondenten zur Lösung herauf verfangen wird, sättigt. Er ist nicht, ausdehnt immer zu sich verfängt oben die Konzentration der Lösung sättigt beständig.
8) was die Löslichkeit ist:
Für ein stellte Substanz in dissolvent Daten bis eine fest, welche zur Temperatur die Löslichkeit gegeben wurde, die, sie der Konzentration der Lösung sättigt zu dieser Temperatur entspricht, die ist zu, wieviel aufgelöstem Stoff einer es gefundenes disciolto im Lösungsmittel für diese bestimmte Lösung ist, in der das Lösungsmittel nicht disciogliersi ulteriorly kann.
9) was das Löslichkeitprodukt ist:
Es ist einfach Gesetz von Tätigkeit von Masse berichtet Reaktion von Ionisierung von aufgelöster Stoff KS = [ zum ][B-]/[ AB ] und siccome würde nicht über Konzentrationen gesprochen werden müssen, aber der Tätigkeit, erzielt es einiges, das [ AB ] einheitlich sein muß und folglich
KS = [ zum ][B-] = Konstante.
10)IST wieviel wert, kennt die Löslichkeit von sie Pb(IO3)2 geschmolzen im Wasser:
Pb(IO3)ionizza 2, wenn Konzentrations und 3 2IO des Pb 2-Haben von von Konzentration 2s gehabt wird.
Ks = [ Pb2 ][IO3-]2 = s * (2 S)2 = 4 s3
11) das es die Bedingung affinchè Formen vom eiligen ist:
In einem Datenmoment das Produkt [ zum ][B-] muß es > vom Ks sein, das konstant sein müssend es auferlegt, daß die Reaktion in Richtung zum aufgelösten Stoff einer auf das Festkörper verschoben wird.
12) beschreiben den Effekt des ione Common:
Die Löslichkeit eines aufgelösten Stoffs einer im reinen Wasser mehr wird betreffend den Fall erhöht, in dem selbe der aufgelöste Stoff einer, der sein ist, disciolto in einer wäßrigen Lösung ist, die ione enthält. Um sie zu errechnen ist es notwendig im Löslichkeitprodukt zu betrachten daß die Konzentration des ione in der Ausgabe mehr erhöht wird während Ks folglich im Komplex konstant bleiben muß verursacht wenig quntità des ione, das nicht allgemein ist das es gleichwertig ist zu sagen daß dem weniger aufgelöster Stoff geschmolzen wird.
13) wenn ich habe, wird ein aufgelöster Stoff einer auf der Unterseite einer Lösung, die es das Bedingung affinchè ist, alle geschmolzen:
Es muß die gleiche Löslichkeit zum Verhältnis zwischen n° von wharves sein und das Volumen der Lösung, tatsächlich die Löslichkeit ist die Konzentration der Lösung, in der der aufgelöste Stoff man geschmolzen wird.
14) wie die Berechnung der Konzentration von den ionischen in der Lösung, wenn eins der 2 im starken Überfluß betreffend ist das andere ist:
Es muß betrachtet werden, daß das ione, das mit kleinerer Konzentration es vorhanden ist, alle fällt, wenn [ zum ][B-] > Ks, die Konzentration des übermäßigen ione das Unterschlagen der Menge des anderen ione erreicht, daß es während die Menge des anderen ione fällt, daß es in gelöster Form Gewinne vom Ks bleibt. In praktischem ist der Effekt des ione notwendig, um im Sinnescommon zu halten.
15) wie die Berechnung der Konzentration von den ionischen in gelöster Form, wenn sie im genauen stöchiometrischen Verhältnis sind:
Die Lösung kann betrachtet werden den Effekt des allgemeinen ione folglich vernachlässigen und betrachten, während sie sie disciolto im reinen Wasser kennt.
16) was die Bedeutung für Aliquoteniederschlag ist:
Die Situation stimmt für zu, welches ein gleiches ein ione den Niederschlag verschiedenen aufgelösten Stoffs 2 feststellen kann eine, in solchem Fall, das 1°, um zu fallen es ist dieses, nach dem kleinere Konzentration dieses ione Common eins verlangt wird.
17) was der Abteilung Koeffizient ist:
Wenn ein aufgelöster Stoff man zum Kontakt mit 2 nicht
mischbaren Lösungsmitteln gesetzt wird, ripartisce zwischen von
unterschieden ihnen 2 bildend Lösungen. Der Abteilung
Koeffizient drückt genau aus, daß das Verhältnis zwischen der
Konzentration des aufgelösten Stoffs einer im Lösungsmittel zu und
in der Konzentration des aufgelösten Stoffs einer im B Lösungsmittel
konstant ist. 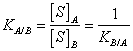
![]()
18) wieviele Gramm des Lösungsmittels in gelöster Form zur Fortsetzung der Extraktion mit V Litern des Lösungsmittels bleiben:
![]()
19) als ein kann von der dissolvent Stoffmenge von grösserem extrahiert werden mit kleinen Litern entsprechend des Lösungsmittels, die nicht im Fall von der vorhergehenden Frage:
Die Extraktion kann nacheinander durchgeführt werden mehr Zeiten mit gleichen Mengen des Lösungsmittels 2°, in solchem Fall
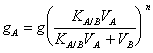
20) Enounce das Gesetz des Henrys auf der Löslichkeit der Gase in den Flüssigkeiten:
Sie erklärt, daß die Löslichkeit eines Gases in einer Flüssigkeit proporziona sie zum teilweisen Druck des Gases im Gleichgewicht mit der Lösung ist, unter der Bedingung daß reagiert das Gas nicht mit ihm.
21) was der Löslichkeitkoeffizient ist:
Es drückt aus, wieviel Gas es unabhängig vom Druck
geschmolzen in einem flüssigen Volumen und ist wird ![]() .
.
22) was der Absorption Koeffizient ist:
Es drückt aus, wieviel Gas im einheitlichen Volumen zur
Temperatur t geschmolzen wird, wenn der Druck des Gases im
Gleichgewicht mit der Lösung 1 ATM gleich ist, ![]() in
dem VG0 das
Volumen ist, das durch zurück zu den Zuständen der Temperatur von 1
ATM und von 0 K geholt wird
in
dem VG0 das
Volumen ist, das durch zurück zu den Zuständen der Temperatur von 1
ATM und von 0 K geholt wird ![]() .
.
23) daß Relation zwischen dem Koeffizienten der Absorption zu und des Löslichkeitkoeffizienten b ist :
![]() wo T0 = 273K
wo T0 = 273K
24) in so fungiert die Natur des Lösungsmittels und des aufgelösten Stoffs man auf der Löslichkeit:
Der Prozeß von einem thermodynamischen Gesichtspunkt in 3 muß analysiert werden wird gebildet:
A) Kommt getrennte Moleküle von soluto(endotermico).
B) Kommt getrennte Moleküle von solvente(endotermico).
c) Kommt Formriegel zu Ihnen zwischen Moleküle des aufgelösten Stoffs und solvente(esotermico)
Energischer Etat von diesen 3 wird andeutet die unterschiedliche Löslichkeit gebildet, insbesondere werden Stoffdaten in den Lösungsmitteln geschmolzen deren Moleküle die Zustände sind, die von der gleichen Art von Riegel intermolecolari(forze von van Der Waals und zweipoliges Moment) Geschenk im aufgelösten Stoff das reine verbunden werden.
25) zu was die entalpy Lösung ist und, zu was sie dient:
Innere Energie PV ist die Veränderung des entalpy (H =) Teilnehmers zum Prozeß der Kreation der Lösung. Es ist nützlich, um festzustellen, wenn die Löslichkeit dieser Datumlösung sich erhöht oder vermindert mit der Temperatur, im fattispecie, den Temperaturzunahmen, wenn der Prozeß endothermisch ist (H > 0), vermindert, wenn der Prozeß exothermisch ist (H < 0).
26) dem Effekt den Druck auf der Löslichkeit hat:
Den Druck erhöhend, vermindert das Volumen und folglich erhöht sich es infolgedessen auf die Konzentration und die Löslichkeit.
27) zu was es dient und diese charakteristische ideale Lösung hat ein:
Bedienstete, zum der zahlreichen Phänomene zu studieren, die den Lösung Prozeß interessieren. Seine Eigenschaften sind:
) das Volumen der Lösung ist er der Summe der Volumen der Mitglieder gleich.
B) wird die Anordnung der Lösung, zum von den Mitgliedern zu gehen nicht von der Entwicklung oder von der Absorption der Hitze begleitet.
28) was ist und welche die logisch verbundene Eigenschaft der idealen Lösungen sind:
Sie sind Eigenschaft, die nur von der Partikelzahl des aufgelösten Stoffs enthalten in der Maßeinheit des Lösung Volumens und folglich vollständig unabhängig von der Eigenschaft Chemie der Mitglieder abhängen. Sie sind:
A) Wenn in der Flüssigkeit kommt disciolto ein aufgelöster Stoff einer, die Dampfspannung kommt geändert.
B) crioscopico Senken
c) ebulloscopico Aufzug.
d) osmotica Druck.
29) was die Dampfspannung ist und wie es kommt geändert zur Fortsetzung der Einleitung des aufgelösten Stoffs einer im Lösungsmittel:
Die Dampfspannung ist der Druck, für den die Flüssigkeit im Gleichgewicht mit seinem Dampf zu einer festgestellten Temperatur ist, es, daß anzeigt gerade den Druck, der zum Dampf konkurriert, daran zu erinnern ist daß eine Flüssigkeit mit seinem Dampf im Verlauf eines Zustanddurchganges koexistiert, für die Umwandlung des Druck Remains konstant für einen Temperatur gegeben.
Wenn ich ein nicht lösliches Lösungsmittel einsetze, hat es distacca folglich bis eins, das Temperatur gegeben wird, nicht das Gleichgewicht für einen Druck und folglich niedrigere Dampfspannung.
30) Enounce das Gesetz von Raoult:
Das relative Senken der Dampfspannung des Lösungsmittels ist dem Bruchmolar des aufgelösten Stoffs einer gleich
![]() Gültig, nur wenn der aufgelöste Stoff man eine
löschbare Substanz nicht das gleiche Konzept mit anderen Worten ist:
Gültig, nur wenn der aufgelöste Stoff man eine
löschbare Substanz nicht das gleiche Konzept mit anderen Worten ist:
Die Dampfspannung einer gegebenen idealen Lösung von den Mitgliedern zu und vom B ist der Summe der Produkte der Dampfspannungen von den einzelnen Mitgliedern dem reinen Zustand für den jeweiligen Bruchmolar in der Lösung gleich.
P = P0Zu * XZu P0B * XB
Wenn die Dampfspannung eines aufgelösten Stoffs einer, als Beispiel B, zur betrachteten Temperatur dann unwesentlich ist
P = P0Zu * XZu
31) in der Berechnung des Senkens der Dampfspannung als Konto des dissosciation wird der Grad gehalten:
![]()
32) als der Aufbau der Phase ist geschätzter Dampf in den Bruchmolaren:
Für das einzelne Mitglied ist es das Verhältnis zwischen seinem Dampfdruck in der Mischung und dem Druck der Dampfgesamtmenge der gleichen Mischung.
33) wenn ich eine flüssige Mischung im Gleichgewicht mit seinem Dampf habe, den Relationen Riegel die 2 gebildet werden:
) der Dampfdruck des einzelnen Mitgliedes im Dampf ist er der Dampfspannung des Mitgliedes dem reinen Zustand für seinen Bruchmolar gleich.
B) das n° von wharves des einzelnen Mitgliedes im Dampf kann er von gewonnen werden PV = nRT den Druck betrachtend, der zum einzelnen Element konkurriert und den es im Punkt erhalten wird).
34) was das Schmelzverfahren ist oder Punkt gefriert:
Es ist die Temperatur, zu der die Dampfspannungen vom flüssigen und festen den gleichen Wert haben.
Wir haben, insofern als die Dampfspannung der Lösung zur Dampfspannung des Lösungsmittels zum reinen Zustand und folglich minderwertig ist, wenn diese Dampfspannung sich verringert, während die Dampfspannung des Körpers dann das Gleichgewicht zwischen der Konstante zwei Dampfspannungen Remains notwendigerweise geschehen muß für eine niedrigere Temperatur.
35) beschreiben das Phänomen des crioscopico Senkens:
Gefriert Punkt der Lösung betreffend ist gefriert Punkt des reinen Lösungsmittels wird gesenkt. DCr = KCr * molalità
36) erklären, warum es kennt sie auf den Gebirgsstraßen in den Winterperioden geworfen wird:
Es weiß, daß sie kennzeichnen Sie von der Tatsache sind, die sich trennt vollständig zu Ihnen ist, folglich im minimalen Fall (als Beispiel ein NaCl) der Faktor von Packwagen ' t Hoff bis 2. gleich ist, der dieses D CR= K CR* molalità * 2 bedeutet, folglich bildet nicht anderes, das, um zu senken zu der die Schwelle das Wasser es einfriert und in solch einer Weise die Eisbildung vermeidet.
37) was der Punkt des Kochens einer Flüssigkeit ist:
Es ist die Temperatur, zu der die Dampfspannung der Flüssigkeit dem externen Druck entspricht.
Wir haben gesehen, daß die Dampfspannung della Lösung minderwertiges alla ist, das dissolvent vapor tension Del Allo und folglich rein ist, wenn diese Dampfspannung Abnahmen es notwendige höhere Temperatur, zwecks dem externen Druck zu entsprechen ist.
38) beschreiben das Phänomen des ebulloscopico Aufzugs:
Der Punkt des Kochens der Lösung betreffend ist gefriert Punkt des reinen Lösungsmittels wird angehoben. Deb = Keb * molalità
39) erklären, warum, wenn es von geworfen wird, sie im Wasser, das sprudelt, dieses scheint, sich zu beruhigen kennt:
Es weiß, daß sie kennzeichnen Sie von der Tatsache sind, die sich trennt vollständig zu Ihnen ist, folglich im minimalen Fall (als Beispiel ein NaCl) der Faktor von Packwagen ' t Hoff bis 2. gleich ist, der dieses D eb= K eb* molalità * 2 bedeutet, folglich bildet nicht anderes, das T EBOLLIZIONEaufwerfen .
40) was eine semipermeabile Membrane ist:
Es ist eine Wand, die zum Durchlauf zu den dissolvent Molekülen verläßt, aber die des aufgelösten Stoffs, der nicht zum Maß des osmotica Drucks von diesem Trainieren übereinstimmt.
41) daß welches ¨ der osmotica Druck:
Es ist die Tendenz der Moleküle des aufgelösten Stoffs im ganzem Volumen des Lösungsmittels zur Einteilung erweiternd.
Sein Ausdruck ist bis dieses der idealen Gase p V = n R T ähnlich, wo n es das n° von wharves des aufgelösten Stoffs ist, während p, V und T das Schwanken dieser Formel, die osmotica P p = Kathodenstrahlröhren ist, auf das soluzione sich bezieht. Auch wo ist c = n/V möglich.
42) zu, was die Tatsache gehabt hat, daß der osmotica Druck mit einem Gesetz ausgedrückt wird, das bis dieses von idealen Gasen ähnlich ist:
Er mißt in der Weise der aller analogen Tendenz der dissolvent Moleküle, in das ganzes Volumen der Lösung zu ihnen zu erweitern Einteilung.
43) daß Verhältnis zwischen dem osmotica Druck p und dem Unevenness in einer Niederlassung eines Schlauches zu U ist:
p = h (Zentimeter) * Dichte (g/cm3) * 981 (speisen Sie), =........ dine/cm2 = [ (.......... dine/cm2 )/1,013*106 ] Atmosphären
44) für eine Lösung von HNO3 im Wasser, ist es notwendig, das binomiale von Packwagen ' t Hoff zu betrachten:
Es ist notwendig, es im Fall zu betrachten wird gegeben uns Eigenschaft relati Sie zu, welchem colligativa, in wieviel HNO3 es eine starke Säure und folglich vollständig getrennt ist, folglich für die der Faktor sie gehen, die ganze logisch verbundene Eigenschaft ist nicht wert 1 aber 2 und kann nicht folglich ausgelassen werden multiplizierte.
45) wieviel den osmotica Druck für eine Lösung von 2 BaClund KCl wertIST:
p = CTOT * R * T
wo CTOT = C(BaCl2) * i (BaCl2) C(KCl) * i (KCl) = C(BaCl2) * 3 C(KCl) * 2
46) wenn 2 Lösungen isotoniche sind:
Wenn sie den gleichen osmotica Druck haben.
