Elettrolitica dissosciation und Elektrolyse
1) für dessen Lösungen die logisch verbundene Eigenschaft verschiedene Werte von jenen Theoretikern annehmen:
Für die Lösungen des aufgelösten Stoffs, die getrennt werden, die sie kennen, die Unterseiten und die Säuren, daß Sayings Elektrolyte kommen. Das Phänomen hat genau muß die Tatsache, daß das Trennen eines Elements das n° der anwesenden Partikel in gelöster Form erhöht und folglich sie die Werte der logisch verbundenen Eigenschaft auch erhöhen müssen, die direkt an das n° der Partikel angeschlossen werden.
2) das es die Ursache des dissosciation von den ionischen des Elektrolyts im Wasser ist:
Es gibt 2 Ursachen:
) hat der konstante grössere Nichtleiter des Wassers ein 80mal betreffend sind das leere, und siccome dieses ist umgekehrt proporziona, das sie zur Energie sie von 2 geladenen lokalisierten elektrischen Arbeitern in einem Abstand r, folgen verbessern, daß die Energie, die notwendig ist, um den Riegel abzubrechen, wenn diese im Wasser ist, er remarkablly das Untergebene betreffend ist die Kraft ist, die notwendig sein würde, wenn der Riegel im leeren waren.
B) bezieht die Solvatisierung die herum zu den jedes ione Formen eine Wassermolekülwolke, die das negative Teil ihres Dipols herausstellt, das ist Sauerstoff mit ein, ist ihre Anziehung so, zum des Riegels abzubrechen, der im Wasser gewordene schwache Person hat und von ionischem des solvata eins zu verursachen zu Ihnen.
3) was die Bedeutung mit dem Formel Na * 5H 2oderist:
Man stimmt, daß ein ione von sodio gehabtes solvatato ist, das wird hydratisiert mit 5 Wassermolekülen zu.
4) als die Gültigkeit der Formeln für die logisch verbundene Eigenschaft wird wieder hergestellt:
Es ist notwendig, sie an den Ionisierunggrad zu binden,
der ihnen für das binomiale von Packwagen ' t Hoff multipliziert
wird, ![]() wo v das n° von wharves von ionischem sind,
dem sie " Größe des
aufgelösten Stoffs bilden.
wo v das n° von wharves von ionischem sind,
dem sie " Größe des
aufgelösten Stoffs bilden.
5) daß welches ¨ die Verdünnung von einer Lösung:
Wenn man in vielen ist und stà fest man sagt, daß man Konzentrate zu Ihnen ist, während, wenn in weit wenig und stà ist, sagt man, daß es verdünnte geworden worden ist.
6) Enounce das Gesetz der Verdünnung von Ostwald in terms di concentration und Grad von dissosciation:
![]() Konstante = der Ionisierung bis eine Temperatur gegeben.
Konstante = der Ionisierung bis eine Temperatur gegeben.
7) wie veränderte die Konstante der Ionisierung mit der Konzentration:
Die Ionisierungkonstante wird in Konzentration ausgedrückt ausgedrückt, während die zutreffende thermodynamische Konstante in Tätigkeit ausgedrückt ausgedrückt wird. Die 2 Konstanten stimmen nur für Lösungen verdünnten viel dieses überein, warum, wenn die Konzentration sich erhöht, die ionischen wie innen über den Kurs Sonntag gefunden werden, der lassen Schwierigkeit bewegen ist. Diese Eigenschaft ist estrinsecata durch den Tätigkeit Koeffizienten f, den genau es mit der Konzentration für über die verringerten elektrostatischen Anziehungen verringert.
8) was die Ionenkraft ist:
Es ist ein Maß der Dichte der Lasten mit der Lösung und folglich mit den elektrostatischen Tätigkeiten, die ein Daten ione vom Teil von allen anderen unterstellt ist.
![]()
9) daß Relation zwischen dem Tätigkeit Koeffizienten f und Ionenkraft m ist :
Für die Lösungen, die von der gleichen Ionenkraft gekennzeichnet werden, ist der Tätigkeit Koeffizient immer der gleiche unabhängig von der Natur anderer anwesender Elektrolyte.
10) daß Verhältnis zwischen der Verdünnung von einer Lösung und dem Grad von Ionisierung ist:
Vom Gesetz von Ostwald wird es daß beobachtet, wenn c
Abnahmen, als Beispiel resultierend aus einer Volumenzunahme und
konstantes K für eine bleiben müssen, die Temperatur, müssen
gegeben wird ![]() dann, wachsen und diese den
dissosciation Grad erhöhend erreicht wird.
dann, wachsen und diese den
dissosciation Grad erhöhend erreicht wird.
11) was die Löslichkeit von einer Substanz in dissolvent Daten ist:
Das Phänomen, das die Löslichkeit bedeutet, zu beschreiben, ist die Tatsache, die das idrolitina im Wasser wirft und es sich nicht vollständig schmilzt, aber es bleibt ein unterer Körper und das Lösung Wasser-idrolitina ist sättigt besagt.
Es wird wie die Zahl Substanz wharves, die in einem Liter der Lösung geschmolzen werden, die ist der Konzentration Molar der Lösung sättigt definiert.
12) was das Produkt von Löslichkeit eines kleinen löslichen Elektrolyts ist:
Es wird von K erreichtc, das am Gleichgewicht einer Lösung eines kleinen löslichen Elektrolyts im Gleichgewicht mit seiner Lösung angewendet wird, sättigt. Es ist warum wichtig, wenn das Produkt der Konzentrationen der Anionen und des cationi den Wert der Löslichkeitproduktform der eiligen Sünde übersteigt, wenn die Konzentrationen nicht das Löslichkeitprodukt überprüfen.
Das viel kleinste man ist der Wert des Löslichkeitproduktes, welches das viel weniger lösliche man kennt sie in der Ausgabe ist.
13) während es errechnet werden kann, kennt die Löslichkeit von sie:
Die dissosciation Reaktion wird genommen und die Konzentration wird von kennt sie gleich s, dopodichè fà das Löslichkeitprodukt gesetzt, das für s der stöchiometrische Koeffizient des jeweiligen ione sich multipliziert, wird die solche Weise zu sXerhalten und es kann gewonnenes s durch das Wurzel x-esima des Produktes von Löslichkeit sein geteilt zu.
14) was der Effekt des ione Common ist:
Es ist das entferntere diminuizione der Löslichkeit eines kleinen löslichen Elektrolyts (als er ist geschmolzenes kleines), zur Fortsetzung der Einfügung in der Lösung von einer von ionischen das Kommen von einen vom dissosciation des gleichen Elektrolyts. Das wird mit der Tatsache erklärt, daß die Reaktion damit geschieht, das ganzes andere ione zu verbrauchen und folglich sie produziertes grösseres eiliges ist.
15) während es erhöht werden kann, kennt die Löslichkeit Daten sie, die als Beispiel der Kalkstein der Waschmaschinen:
Es ist notwendig, die Reaktion zu erleichtern, welche die Produkte unterschlägt, das geschieht sie nicht mit kleiner Pinzette, aber mit Säuren und günstigen Unterseiten, die mit den einzelnen ionischen geordnet werden und in solch einer Weise stellen Sie Substanzen her, die, um Richtung zu allen zu geben nicht zum Festkörper sein müssen.
16) daß Verhältnis zwischen der Löslichkeit und der Temperatur ist:
Das gleiche Verhältnis, daß es zwischen gibt, welches Gleichgewicht und die Temperatur, die für die Anmerkung das Gleichgewicht in Richtung zu den Reagenzien verschiebt, folglich, kennt sie nicht disciolto, wird geschmolzen die Temperatur teilweise erhöhend.
17) was der gegenwärtige elektrische Arbeiter ist:
Es ist ein sauberer Fluß der Aufladungen, denen pu² zu, bevor Platz in den Leitern und von der zweiten Sorte haben Sie. In zuerst ihm liegt an der Bewegung der Elektronen, in den zweiten liegt anstatt an der Bewegung von den ionischen.
18) das è die Einheit, für die Durchgang des Stromes in den Leitern der Sorten 1ª gehabt wird:
Die Leiter der Sorten 1ª sind die Metalle und die Flüssigkeiten und innen werden sie der Strom ausschließlich von den Elektronen transportiert. Solches Verhalten sehr wird vom metallischen Riegel definiert, der ein Netzmagen des ionischen Vorbetrachtungen positi zu Ihnen und herum sie eine Elektronwolke.
19) das è die Einheit, für die Durchgang des Stromes in den Leitern der Sorten 2ª gehabt wird:
Die Leiter der Sorten 2ª sind kennen sie Körper und Flüssigkeiten und die Elektrolytlösungen, festgesetzt, dem von kennen sie, Unterseiten ist, oder Säuren disciolti in acqua. die saubere Bewegung zur Fortsetzung der Anwendung eines möglichen Unterschiedes sie elektrischer Arbeiter, in 3 werden gebildet erzeugt werden:
) der Generator unterschlägt er Elektronen zu einem elettrodo(anodo) und er liefert sie an altro(catodo), folglich, welches die Anode positiv geladen wird, während die Kathode negativ geladen wird.
B) zieht die Kathode ionisches positi Sie, daß sie Sie Form Sie vom dissosciation des Stoffelektrolyts im Wasser sind, solche ionische, welche an, kommt positi zu Ihnen Anrufe cationi zu Ihnen, herum zum Kathode Cer ist eine große Zahl.
die Anode zieht ionisches Sie verweigert, daß sie Sie Form Sie vom dissosciation des Stoffelektrolyts im Wasser sind an, solche ionische verweigert zu Ihnen kommt Anrufanionen zu Ihnen, herum zum Anode Cer ist eine große Zahl.
c) Wir müssen mit 2 Verteilungen der Aufladungen in Verbindung treten, die angezogen werden, aber wir von der Übertragung des Stromes können nicht sein Durchgang in wieviel modalità elektrischer Arbeiter in den 2 Leitern verschieden ist, dieses fließen anstatt in, wieviel von den Reaktionen der riduzione(la Lösung erwirbt Elektronen) zur Kathode hergestellt wird und der ossidazione(la Lösung Elektronen) zur Anode überlassen Sie.
20) was eine Kathode ist:
Es ist die Elektrode oder das metallische Blatt zum Aufsteigen sie negativ in Richtung zu, welchem migrano das anwesende cationi in gelöster Form.
21) was der Widerstand eines Leiters ist:
Es ist der Faktor, die den Effekt legieren, der der gegenwärtige elektrische Arbeiter zur Ursache, der der mögliche Unterschied sie ist, es, das er von jedem verschiedenen Material charakteristisch ist ist und an seinen Abschnitt, an seine Länge und an sein resistività zweite 2ª das Gesetz des Ohms gebunden wird:
![]()
22) was die Konstante für eine elettrolitica Zelle ist:
Es ist das ![]() Verhältnis, das genau eine
Konstante für eine elettrolitica Zelle und Maß in Zentimeter
-1sind.
Verhältnis, das genau eine
Konstante für eine elettrolitica Zelle und Maß in Zentimeter
-1sind.
23) was die K Leitfähigkeit eines Leiters ist:
Es ist das umgekehrte des Widerstandes und zeigt an, daß wieviel genau ist ein Leiter, verleihen Sie zu vom gegenwärtigen elektrischen Arbeiter gekreuzt werden
![]() wo c das
umgekehrte des resistività ist und Leitfähigkeit oder spezifische
Leitfähigkeit benannt wird.
wo c das
umgekehrte des resistività ist und Leitfähigkeit oder spezifische
Leitfähigkeit benannt wird.
24) die die Faktoren sind, die die K Leitfähigkeit von einer Lösung beeinflussen:
Die sichere Leitfähigkeit wird an n° von cationi und von anwesenden Anionen im Wasser gebunden, und diese, die wir gesehen haben, wächst mit der Verdünnung, die mit dem Volumen ist. Dann wird sie an Mobilität von diesen ionischen gebunden.
25) wieviel die K Leitfähigkeit von 2 Prozessen der Übertragung ist, die Ähnlichkeit geschehen:
Es ist die Summe der conductances der einzelnen Prozesse.
26) wird spezifische Leitfähigkeit c einer wäßrigen Lösung von spezifischer Leitfähigkeit c des Wassers beeinflußt:
In wieviel das c des Wassers nicht viel Tiefland ist, gleichwohl für Masse extreme Präzision và es zum gemessenen c unterschlug.
27) was das Gewicht ist, das für einen Elektrolyt gleichwertig ist:
Es ist das Verhältnis zwischen seinem Molekulargewicht und dem Produkt des n° von wharves von cationi, die für das n° der verbundenen positiven Aufladungen zu jeder Größe gebildet werden, als Beispiel für Cu(SO4), das als Bezugscu 2wir nimmt, dieses PET = PM/(1*2) haben. So bewerten identisches, wenn betreffend das Anion errechnet wird (KENNT4)2 .
28) was die Konstante von Faraday ist:
Es ist Lasten positives Gesamt- oder Negativ, die vom kompletten dissosciation von 1 erreicht werden können g-gleichwertig von, welcher Elektrolyt, es dem Produkt des n° von Avogadro für Lasten mit dem einzelnen Elektron gleich ist. ? und = F.
1 Faraday = 96487 Coulomb = 26.8 Amperestunde
29) was der Äquivalentleitwert L ist:
Es schlägt sich vor, um die Leitfähigkeit einer Lösung
an seine Konzentration ![]() zu binden, in der N
Normalität ist, die dem Produkt des molarità für das n° der
Aufladungen des ione gleich ist. Es: H2 ist notwendig, um für 2 das molarità
zu multiplizieren.
zu binden, in der N
Normalität ist, die dem Produkt des molarità für das n° der
Aufladungen des ione gleich ist. Es: H2 ist notwendig, um für 2 das molarità
zu multiplizieren.
Es kommt definiert wie die Leitfähigkeit dieses Volumens der Lösung, die disciolto 1 Elektrolytäquivalent enthält, gemessen zwischen 2 Elektroden Ähnlichkeiten zum Abstand von 1 Zentimeter.
30) was die Äquivalentleitwertbegrenzung L ¥ist :
Es wird beobachtet, daß für Lösungen schwache Leute, die Verdünnung auch erhöhend, nicht mehr Zunahme des Äquivalentleitwertes hat, folglich kommt der Maximalwert von aufholt ihm definierte Begrenzung, ist es Vermächtnis zur Tatsache, daß der Erhöhung der Verdünnung auch das dissosciation erhöht wird, bis zum Maximalwert bis = 1, das er L ¥genau folglich entspricht, nützlich ist, warum es die Leitfähigkeit von der Konzentration löst und folglich es nur an Mobilität des ione gebunden bleibt.
31) daß Verhältnis zwischen dem Äquivalentleitwert und der Äquivalentleitwertbegrenzung ist:
![]()
32) Enounce das Gesetz der Verdünnung von Ostwald in L und L¥ ausgedrückt :
![]()
33) Enounce das Gesetz von Kohlraush:
Jedes ione, das es im charakteristischen und konstanten Maß zur Äquivalentleitwertbegrenzung auf einen Elektrolyt beiträgt, und sein Beitrag ist von der Natur des Kommens von anderem ione vom dissosciation des Elektrolyts unabhängig.
![]()
34) warum L¥ ionische (H3oder ) ED (OH-- ) im Wasser viel mehr erhöhter Respekt zu anderen ionischen ist:
Die erhöhte Leitfähigkeit liegt nicht an der bestimmten Mobilität von diesen ionischen, aber zur Tatsache, der im Wasser sie im Durchgang viele Riegel bilden und herstellen, die, OH- unter dem infuence von einem elektrischen auffangen, folglich zu den Protonbewegungen von einem Molekül zum anderen Verfangen herauf die günstige Elektrode.
35) was Elektrolyse ist:
Es ist das Phänomen, für das eine chemische Umwandlung einer Lösung mittels des ossidoriduzioni gehabt wird, wenn dieses vom gegenwärtigen elektrischen Arbeiter gekreuzt wird. Das Phänomen hat muß, der ionischen Geschenke in gelöster Form auf der jeweiligen Elektrode leerend. Die Substanzmenge wird an die Menge von Elektrizität gebunden, die die Lösung und zum Gewichtäquivalent der betrachteten Substanz kreuzt.
36) Ursprung der Namenselektrolyse:
Lisi = Bruch, stimmt folglich den Bruch der Riegel für über elektrischen Arbeiter zu.
37) Relation zwischen der Batterie und Elektrolyse:
Sie sind 2 ergänzende Prozesse, das 1° ist es spontan und es hat den Bereich, zum zur elektrischen Leistung der ossidoriduzione Reaktionen durch zu produzieren, während das 2° es nicht spontan und Notwendigkeit der Energie ist, die von einer Batterie geliefert wird, um von den Reaktionen von ossidoriduzione zum Ziel zu verwirklichen, um sich zu den Substanzen zu trennen zu den reinen Zustandgeschenken in gelöster Form, wie ionisch.
38) bei Elektrolyse, die Elektrode die Kathode ist, der die Anode und die es sie verbessert, haben Sie sie:
Die Kathode ist für Definition die Elektrode, in der die Verkleinerung geschieht und folglich die Substanz zum reinen Zustand, für geschehen die Verkleinerung gebildet wird, Nachfrageelektronen, an die Lösung zu liefern, die dieses mal von der Batterie geliefert wird und folglich die Kathode die negativere Elektrode ist. Der positive Pfosten der Batterie schloß an die Elektrode Anode an, von ciuccia über folglich übereinstimmenden Elektronen die Anordnung des ionischen positi zu Ihnen, daß sie in Wasser gereinigt erhalten und gegangen werden, auf der Kathode mit dem Kommen von den Elektronen von der Batterie wiederzuverbinden.
39) habend in gelöster Form n ossidoriduttive Klammern, die es zur Anode geleert wird:
Das Erinnern an das zur Anode, welche die Oxidation, die ossidoriduttiva Klammer geschieht, wird oxidiert, Aufsteigen habend sie elettrodico mehr Unterseite, während zur Kathode geschehen die Verkleinerung, das Haben der Klammer verbessert sie das positivere elettrodico leert.
40) ist es möglich, die Aufspaltung der alkalischen Metalle und des alkalischen terrosi in den wäßrigen Lösungen zu erreichen:
Nicht in wieviel sie Aufsteigen sie das elettrodico Untergebene betreffend ist die Klammer H 3haben,oder / H2 und folglich ist es dieses zum ridursi.
41) Enounce die 2 Gesetze von Faraday auf Elektrolyse:
) sind die Mengen der Substanzen, die zu den Elektroden sie gebildet werden, proporziona sie zur Elektrizität Menge, die die Lösung gekreuzt hat.
B) sind die Gewichte von 2 verschiedenen Substanzen, die aus der gleichen Menge von Elektrizität produziert werden, proporziona sie zu den Gewichtäquivalenten der gleichen Substanzen.
42) produzierte Enounce die Formel von Faraday, zwecks die Menge der Substanz zu gewinnen durch Elektrolyse:
![]() wo F die Konstante von Faraday ist, ist das gleichwertige
Gewicht wie für das ossidoriduzioni geschätzte Dividende, die das
Molekulargewicht der Substanz für das n° der Elektronen zu Ihnen
austauscht. In wharves ausgedrückt kann der Anteil herauf
anstatt eingestellt werden:
wo F die Konstante von Faraday ist, ist das gleichwertige
Gewicht wie für das ossidoriduzioni geschätzte Dividende, die das
Molekulargewicht der Substanz für das n° der Elektronen zu Ihnen
austauscht. In wharves ausgedrückt kann der Anteil herauf
anstatt eingestellt werden:
1 Faraday: 1 Mole = x_moli Q:
tatsächlich ist 1 Faraday die Menge der Lasten, die zu einer Elektrongröße verbinden.
43) Estrinsecare die Konsequenzen des Durchganges des Stromes in einer Lösung:
Alkathode geschieht die Verkleinerung mit Anordnung der Substanzen, die allo nicht Ionen ist, die Generator-Versorgungsmaterialien affinchà Elektronen, das geschieht, alla Anode geschieht das Durchlaufoxidation nel della, das die Elektronen das erbrachte Al kommen, das in solcher Weise den Stromkreis schließend erzeugt.
44) was die Bedeutung für die faradico Übertragung ist:
Die Menge der Substanz produziert in praktischem ist betreffend die minderwertig, die für über insturarsi der zahlreichen Prozesse von ossidoriduzione errechnet, zwischen denen, ionischen H 3leerend,oder folglich es definierte eine faradico Übertragung der Elektrolyse kommt
![]() Äquivalent zur gegenwärtigen Übertragung
Äquivalent zur gegenwärtigen Übertragung
![]()
45) was Aufsteigen sie von Aufspaltung von einer Lösung ist:
Es ist Aufsteigen es undD , über dem hinaus die Lösung eine verwiesene Proportionatität zwischen dem möglichen Unterschied hat, wendete sie und die Intensität des Stromes an, der die Lösung kreuzt. Vorher, daß es kommt, verfing sich oben dieses verbessert sie zum Wachsen der angewandten Spannung, die der Strom der bedeutungslosen Weise sich erhöht.
46) Enounce das Gesetz des Ohms für die Leiter der Sorten 2ª:
![]()
47) zu dem verursacht, ist das beschriebene Phänomen Vermächtnis vom Aufsteigen sie von Aufspaltung:
Es ist die Summe von 2 Faktoren;
) sobald sie die Verkleinerung und die Oxidation anfangen, wird eine innere Batterie zur Lösung erzeugt, die fem das externe wie innen ein potenziometrico Stromkreis entgegengesetzt wird und erhöht sich auf die externe Spannung, die das fem der inneren Batterie in der Weise wächst, die bis das Erreichen zu einem Wert specular ist undbesagtes R verbessert sie Reversible der Ionisierung, über dem hinaus die externe Batterie den Windward hat.
B) ist der Prozeß in der Wahrheit nicht umschaltbar und die Prozesse, die Elektrolyse bestehen, müssen angepaßter Geschwindigkeit geschehen, wenn einer von ihnen langsamer ist, werden der notwendige dieser Overstrain Ausgleiche dieses langsame Stadium.
48) während es geschätzt wird, verbessert es sie von Aufspaltung für eine, die elettrolitica Zelle gegeben wird:
UndD = UndANODO - UndKATHODE
wo und ANODE das Aufsteigen ist, das ihnen zur Oxidation Reaktion verbindet, die der Anode geschieht, die diese zum niedrigeren Aufsteigen sie von Nernst zwischen allen ist. Und KATHODE ist anstatt das Aufsteigen, das ihm zur Verkleinerung Reaktion verbindet, die der Kathode geschieht, die diese zum Aufsteigen sie von höherem Nernst zwischen allen ist.
49) das Wissen, daß der Overstrain der Entladung des Wasserstoffs auf Nickel 0,21v wertIST, welches die Reaktion feststellt und sie verbessern sie zu verbundenem es:
2 H3Oder 2e ® H2 (g) 2 H2Oder

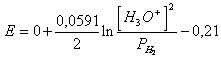
50) das Wissen, daß der Overstrain des Sauerstoffes auf Platin 0,48v wertIST, welches die Reaktion feststellt und sie verbessern sie zu verbundenem es:
6 H2O ® Oder2 (g) 4 H3Oder 4e
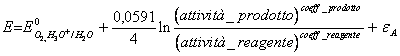
![]()
51) das Prozesse im Verlauf der Elektrolyse erzeugt werden:
) neues ionisches in gelöster Form, das sie in die gepreßten der Anode zerstreuen müssen, um die zu ersetzen, die geleert werden.
B) die ionischen sind in der Wahrheit solvata zu Ihnen und sind folglich notwendig von der zusätzlichen Energie, um sie zu entwässern.
c) die ionischen leert, das ist, zu Ihnen müssen verbinden, um einen beständigen Kristall herzustellen, das verlangt es Energie.
d) Wenn die Substanz, die für Verkleinerung erzeugt wird, zum Zustand des Gases ist, muß dieses von der Anode getrennt werden.
52) was ein zu versilbern ist voltametro,:
Es ist ein Instrument in einer Position zum Messen der Elektrizität Menge, die einen Stromkreis der Daten einfach mit dem Gesetz von Faraday kreuzt, das die Substanzmengen mißt, daß sie auf der Kathode niedergelegt werden. Es wird von zwei silbernen Elektroden festgesetzt, die in eine Lösung von Ag(NO) 3eingetaucht werden .
