Säuren und Unterseiten
1) was eine Säure ist:
Ein welche fähige chemische Sorte, zum eines Protons (ione H) zu erbringen zu einer Unterseite.
2) was eine Unterseite ist:
Ein welche fähige chemische Sorte, das Proton anzunehmen von einer Säure erbrachte.
3) was die Bedeutung für konjugierte Klammer ist:
Man stimmt darin überein, daß eine Säure für Verlust des Protons in einer Unterseite umgewandelt wird und in der analogen Weise die Unterseite für Erwerb eines Protons in einer Säure umgewandelt wird. Die konjugierte Klammer folglich wird von einer konjugierten Säure und von einer konjugierten Unterseite festgesetzt.
4) was die Bedeutung für anfolita Substanz ist:
Eine Substanz wie das Wasser stimmt zu, oder das Ammoniak, das reagieren kann, ist wie Säuren die wie Unterseiten.
5) was die Bedeutung durch Kraft einer Säure ist:
Die Kraft einer Säure ist ein Maß seiner Fähigkeit, ein Proton zu erbringen.
6) stimmt Sache durch Kraft von einer Unterseite zu:
Die Kraft einer Unterseite ist ein Maß seiner Fähigkeit, ein Proton zu binden.
7) wie Maß die Kraft einer Säure betreffend ist diese einer einer anderen Säure:
Eine Klammer ist notwendig, um einen Hinweis zu regeln,
der unter dissolvent Form, normalerweise das Wasser und die Konstante
der Ionisierung der Reaktion zu errechnen acid/base 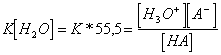 ist, in der genau die Konzentration des konstanten Wassers
gesollt hat. Von diesem Relation fà anderes, das, ES zu
konfrontieren mit H 3HAT,oder tatsächlich, wenn die Säure
stärker vom ione ossonio dann das Gleichgewicht ist nicht in Richtung
in Richtung den Reagenzien und zu K ist viel klein verschoben wird,
andernfalls viceversa.
ist, in der genau die Konzentration des konstanten Wassers
gesollt hat. Von diesem Relation fà anderes, das, ES zu
konfrontieren mit H 3HAT,oder tatsächlich, wenn die Säure
stärker vom ione ossonio dann das Gleichgewicht ist nicht in Richtung
in Richtung den Reagenzien und zu K ist viel klein verschoben wird,
andernfalls viceversa.
8) warum in der Berechnung des KW die Konzentration des konstanten Wassers betrachtet werden kann:
Warum sie wenige trennt, ist viel zutreffend, daß KW 10 -14wertIST, dem für ein Gleichgewicht es anzeigt, daß die dissosciation Reaktion ganz in Richtung zu den Reagenzien verschoben wird.
9) was die Bedeutung für Planiereneffekt des Lösungsmittels ist und da es behoben wird:
Man stimmt darin überein, daß er nicht gefolgt wird, um eine Priorität zwischen den Säuren zu verursachen, die betreffend H 3 stärkersindoder . Das Problem ist entschlossenes Wählen, dem Lösungsmittel das Wasser aber Essigsäure CH3COOH, die, die eine konjugierte Klammer hat, von einer Unterseite viel schwachen Person festsetzte, nicht eine kleinere Fähigkeit haben, Protone des sauren forte anzuziehen.
Ein analoges Verhalten wird auch für das Maß der Kraft einer Unterseite gehabt, wenn die Unterseite zum Maß stärker von der Unterseite OH- ist-.
10) in dem unterteilen Kategorien Mittel, in denen werden eine oder mehr ossidrilici Gruppen enthalten:
Ossiacidi E ' dieses der Fall in welchem 3° das Elementletzte man elettronegativo zur Gleichheit des Sauerstoffes folglich dieses ist, leert sein elettronegatività in der Anziehung in Richtung zum H, mit dem sie folglich einen stark Ionenriegel bildet, der im Wasser leicht angegriffen kommt, trennt folglich H und das Mittel ist folglich eine Säure. HClO.
Idrossidi ist dieses der Fall in, welchem 3° das Element es weniger elettronegativo betreffend ist Wasserstoff folglich zwischen Sauerstoff ist und 3° das Element einen stark Ionenriegel, der im Wasser leicht angegriffen kommt, trennt folglich das OH- bildet- und das Mittel ist folglich eine Unterseite. KOH.
Anfoliti E ' dieses der Fall in welchem 3° der Elementsauerstoff das elettronegativà hat, das bis dieses des H folglich ähnlich ist, bildet Ionenriegel mit beiden Elementen und zu zweitem der Situation, folglich, welches die zusammengesetzte Unterseite in der LageIST, wie eine oder eine Säure benommen zu werden.
11) zu, was die Kraft einer Säure gebunden wird:
) zum Unterschied zwischen dem n° der Atome von oder und dem n° der anwesenden Atome von H im Mittel, tatsächlich sind mehr Atome als oder und mit mehr Kraft widersteht die Säure zur Unterseite, daß es, das es ein Proton unterschlagen möchte.
B) vermindert die Kraft einer Säure mit dem Wachsen der Maße des Atoms zentriert sie, die Zeit welches sie vermindern zum Wachsen des n° der Elektronen auf der externeren Bahn festsetzen. Tatsache ist, daß viel mehr Elektronen weit von den Kern viel einfacher können zum Atom in der Ausgabe unterschlagen werden sind.
c) der poliprotici Säuren Verringerung die Kraft der Säure das Überschreiten vom ersten Ionisierung n-esima zur Ionisierung.
d) Für die Atome, die nicht Sauerstoff enthalten, entwickelt sich die Kraft zu das Wachsen der Maße des Atomvermächtnises zum H
12) was das Ionenprodukt des Wassers ist:
Es ist die Konstante, die an die Reaktion der Ionisierung von acqua das K W= gebunden wird [ H3oder ][OH-] = 10-14 .
13) was das cologaritmo des Ionenproduktes des Wassers ist und was anzeigt:
Das cologaritmo ist es eine Weise, die Zahlen auszudrücken damit, um die negativen Energien, folglich für das Wasser pK zu entfernenW = 14, aber das Interessieren, was die Tatsache ist, daß pH pOH = 14 mit pH das cologaritmo der Konzentration von ionischem habend anzeigte [ H3oder ]. Im Fall vom reinen Wasser pH = pOH und die Lösung kommt es besagtes Neutrales.
14) wenn der pH wieviel 2.35 ist, die Konzentration von ionischem wertIST [ H3oder ]:
[ H3Oder ] = 10 - 2.35
15) wenn eine wäßrige Lösung acida ist und wenn grundlegend oder alkalisch:
Eine Lösung ist acida, wenn sie einen pH hat, der von 7 kleiner oder ein pOH analog ist, das von 7 grösser ist. Dieses, warum eine Säure in gelöster Form die Konzentration von ionischem erhöht [ H3oder ] und folglich das cologaritmo ist kleiner. Die Lösung ist anstatt im ergänzenden Fall grundlegend.
16) daß Relation zwischen der Kraft von acido ein K zuund die Kraft K B seiner konjugierten Unterseite ist:
Das Produkt der Konstante von dissosciation einer Säure und der Konstante von dissosciation seiner konjugierten Unterseite ist dem Ionenprodukt des Wassers gleich, oder in einer generalisierten Weise ist er dem Ionenprodukt des Lösungsmittels gleich. KZu * KB = KW.
17) verzeichnen etwas starke Säuren:
Überchloriges saures HClO4 , Hydrochlorate HCl, Stickstoffhno3 , schwefliges H2KENNE ich4 , bromidrico Hbr, iodidrico HI, selenico H2SeO4 , HSCN, HIO3
18) wieviel pH der wäßrigen Lösungen der Säuren und der starken Unterseiten mit Konzentration > 10 -6wertIST :
Das dissosciation des Wassers kann vernachlässigt werden und folglich ist die Konzentration von ionischem [H3 oder ] der Konzentration der Säure oder, im Fall von einer Unterseite gleich, der Konzentration von ionischem [ das OH--] er ist gleich der Konzentration der Unterseite.
19) wieviel pH der wäßrigen Lösungen der Säuren und der starken Unterseiten mit Konzentration < 10 -6wertIST :
Das dissosciation des Wassers kann nicht vernachlässigt werden und folglich für eine Säure wird die Konzentration von ionischem [H3 oder ] von gewonnen:
[ H3oder ]- c [ 2 H3oder ] - KW = 0.
Im Fall von einer Unterseite anstatt ist die Konzentration von ionischem [ dasOH-- ] OH- gewonnenes dalla [-]- 2 c [ OH--] - KW = 0.
20) wieviel pH von einem die wäßrige Lösung einer sauren schwachen Person wertIST:
Es soll notwendig ionisches [ H 3oderKommenvon ] vom dissosciation des Wassers vernachlässigen, das
Gesetz der Tätigkeit der Masse anwendend seien Sie erreichtes ![]()
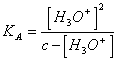 , von diesem soll es notwendig [ H 3oder] 2K * [ H
3oder] - c beheben * KA = 0
oder im Fall diese 10K <-3 EG > 10-3 kann H 3 oder]zum Nenner vernachlässigt werden [ erreichend
, von diesem soll es notwendig [ H 3oder] 2K * [ H
3oder] - c beheben * KA = 0
oder im Fall diese 10K <-3 EG > 10-3 kann H 3 oder]zum Nenner vernachlässigt werden [ erreichend ![]() .
.
21) deren Gesetzlegierung der Grad von dissosciation zu zur Konzentration einer sauren schwachen Person und zu Konzentration [ H3oder ]:
[ H3oder ] = c * zu
22) verzeichnen einige starke Unterseiten:
Das idrossidi der alkalischen Metalle NacOh, des KOH, des LiOH und des alkalischen terrosi Ca(OH)2 , des Ba(OH)2 , 2Sr(OH) , des usw.....
23) deren Gesetzlegierung der Grad von dissosciation zu zur Konzentration von einer niedrigen schwachen Person und zu Konzentration [ OH--]:
[ OH--] = c * zu
24) wieviel pH von einem die wäßrige Lösung von einer niedrigen schwachen Person wertIST:
Es ist notwendig, das ionische [ das OH- -]Kommen von vom dissosciation des
Wassers zu vernachlässigen, wird das Anwenden des Gesetzes der
Tätigkeit von Masse zu ![]()
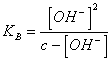 erreicht, von diesem ist es
notwendig, [ das OH- -]2K Bzu
beheben * [ OH--] - c * KB = 0 oder
im Fall, daß K10 B <-3 EG > 10-3 vernachlässigt werden kann [ OH--] zum Nennererreichen
erreicht, von diesem ist es
notwendig, [ das OH- -]2K Bzu
beheben * [ OH--] - c * KB = 0 oder
im Fall, daß K10 B <-3 EG > 10-3 vernachlässigt werden kann [ OH--] zum Nennererreichen ![]() .
.
25) als der pH wird von den poliprotici sauren Lösungen geschätzt:
Die Berechnung des pH ist viel kompliziert in, wieviel notwendig ist, um Konto der aufeinanderfolgenden Ionisierungen zu halten, aber in praktischem es stark acida nur 1ª das Ionisierung folglich pu² ist, zum der Konzentration nur zu betrachten anfängt sie von ionischem [ H3oder ].
26) während die Konzentrationen von den ionischen geschätzt werden, die Ursprung von den aufeinanderfolgenden Ionisierungen einer poliprotico Säure nehmen?
Es ist notwendig, die Konzentrationen zu gewinnen, die zu 1ª die Ionisierung, um zu beobachten zugehörig sind daß, wenn ruhiges H in produzierter Säure ist, dieses in seine Umdrehung zum ionizzarsi ausdehnt, folglich ist die vorher gefundene Konzentration, nicht daß Ende aber sie ulteriorly decrementata in Abhängigkeit von dem dissosciation Grad gehen.
27) was eine Lösung Auflage ist:
Es ist eine Lösung, die plötzlichen Veränderungen des pH, selbst wenn gekommen in es, entgegengesetzt wird vorstellte starke Säuren oder Unterseiten.
28) die die 3 grundlegenden Arten der Lösungen Auflage sind:
) Lösung einer sauren schwachen Person und sein kennt es
es, denn esIST La wert ![]()
B) Lösung einer niedrigen schwachen Person
und sein kennt sie, denn sieIST La wert ![]()
c) Mischung von kennt sie einer polibasico Säure, denn sieIST La wert
![]()
29) das Reaktionen bis eine der 3 grundlegenden Arten der Lösungen Auflage tragen:
) tragen sie zum sauren Fall, den die schwache seine Person sie die Reaktionen kennt:
*) saure starke Unterseite des debole(in Überflußes)
*) kennt starke Säure sie des sauren debole(in Überflußes)
B) tragen sie zur Ausgangssituation, welche die schwache seine Person sie die Reaktionen kennt:
*) niedrige starke Säure des debole(in Überflußes)
*) kennt starke Unterseite sie des niedrigen debole(in Überflußes)
c) trägt zum Mischung Kasten von kennt sie der poliprotico Säure die Reaktionen:
*) kennt sie starke Säure des Säuren poliprotici(in Überflußes)
*) poliprotici Säuren oder sie starke Unterseite des sali(in Überflußes).
30) wenn eine Lösung Auflage die maximale Leistungsfähigkeit hat:
Wenn der pH der Lösung es nah an dem Wert von pK zudieser Überprüfung ist, wenn die Konzentration von sie kennt, ist nahe bei der Konzentration von saurem oder von jeweiligem der Unterseite.
31)IST wieviel wert, kennt der pH einer wäßrigen Lösung von sie ableitend von einer starken Unterseite und von einer starken Säure:
ErIST 7 wert, wieviel der pH des Wassers, tatsächlich die starke Unterseite Platz zu einem Anion gibt, das im Wasser nicht reagiert und analog das catione, das vom kompletten dissosciation der starken Säure ableitet. Diese Art der Reaktion wird von der Neutralisation benannt und zur Bezeichnung, die die erreicht wird, ist eine Lösung von un kennt sie. Die Hitze, die in der Neutralisation erbracht wird, ist konstant undIST -13680 cal wert.
32)IST wieviel wert, kennt der pH für sie ableitend von einer starken Unterseite und von einer sauren schwachen Person:
Das catione, das von der Unterseite stark ableitet, reagiert nicht im Wasser, während das Anion, das von der sauren schwachen Person ableitet, mit ionisches OH- bildendem undzum Platz zu einer alkalischen Lösung folglich schwach gebendem Wasser - reagiert. Die betrachtete Konstante der Ionisierung des ione als niedrige schwache Person erreicht vom KB = K mit Kzu und die Konzentration ist, daß ein von sie kennt, die pH Dose folglich wird errechnet von [ das OH--]2 KB * [ OH--] - c * KB = 0.
Der pH der Lösung ist sie aber auch berechenbar direkt
durch ![]() .
.
Sie ist als die Summe einer Reaktion der Neutralisation thinkable und eine Reaktion der Ionisierung, zur Bezeichnung di.le, die sie erreicht wird, kennt sie einer sauren schwachen Person und einer starken Unterseite.
33)IST wieviel wert, kennt der pH für sie ableitend von einer niedrigen schwachen Person und von einer starken Säure:
Das Anion, das von der Säure stark ableitet, reagiert nicht im Wasser, während das catione, das von der niedrigen schwachen Person ableitet, mit ionisches H 3 bildenden oderzum Platz zu einem Lösung acida folglich schwach gebenden Wasser und reagiert. Erreicht die betrachtete Konstante der Ionisierung des ione als saure schwache Person von der relativen Unterseite durch das K = K mit KB und die Konzentration ist, daß ein von sie kennt, der pH, den es von [ H 3 oder ]2K * [H 3 oder ]-c folglich errechnet werden kann * KA = 0.
Der pH der Lösung ist sie aber auch berechenbar direkt
durch ![]() .
.
Sie ist als die Summe einer Reaktion der Neutralisation thinkable und eine Reaktion der Ionisierung, zur Bezeichnung di.le, die sie erreicht wird, kennt sie von einer niedrigen schwachen Person und von starker Säure.
34)IST wieviel wert, kennt der pH einer wäßrigen Lösung von sie ableitend von einer niedrigen schwachen Person und von einer sauren schwachen Person:
Beide ionischen reagieren im Wasser, in der LageSIND
folglich, erreichte basische Lösungen, acide zu sein, oder Neutrales
in der Tugend der Kraft von Ihnen Respekt zu Ihnen ionisch und
unabhängig von der Konzentration von ihr kennt sie. Der pH ist
er mit bestimmbar: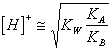 oder direkt
oder direkt ![]() .
.
Er ist als die Summe einer Reaktion der Neutralisation thinkable und 2 Reaktionen der Ionisierung, zur Bezeichnung di.le, die sie erreicht wird, kennt sie der sauren schwachen Person und Unterseite der schwachen Person.
35)IST wieviel wert, kennt der pH einer wäßrigen Lösung von sie ableitend von einer Säure, die stark von der Ionisierung einer poliprotico Säure ableitet:
Wenn die Säure stark die Ionisierung ist, die sie komplett ist und die Säure vom Ableiten sie ist eine saure schwache Person deren pH es von [ H 3 oder]2 K geschätztwird * [ H3oder ] - c * KA = 0 betrachtend wie KA2, daß Verwandter einer zu 2ª die Ionisierung stark der poliprotico Säure und als Konzentration dieses von sie kennt, welcher saurer schwacher Person es konstituierend ist.
36)IST wieviel wert, kennt der pH einer wäßrigen Lösung von sie ableitend von einer Säure, die von der Ionisierung einer saures poliprotico schwachen Person ableitet:
Durch ein Lösung acida, ein grundlegendes oder Neutrales
können gehabt werden das pH es berechenbar ist 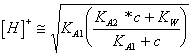
daß es zu im ![]() Fall einfacher
geworden werden kann, daß c betreffend K A1 undK unwesentliches Wbetreffend ist K A2
*cunwesentlich ist.
Fall einfacher
geworden werden kann, daß c betreffend K A1 undK unwesentliches Wbetreffend ist K A2
*cunwesentlich ist.
37) was die Aminosäuren ist:
Es ist eine Kategorie anfoliti, der sie im gleichen Molekül die Gruppe Säure - COOH und die Hauptgruppe - NH 2enthalten .
38) was der isoelektrisch Punkt ist:
Es ist dieser Wert des pH, für den die protonata Form und die anionische Form die gleiche Konzentration haben, es wird gewonnen von:
![]()
39) was die Bedeutung für tiration ist:
Die Ermittlung stimmt analytics der inkognito Menge von einer zu, die das sostanza gegeben wird, das sie in der kompletten Weise mit einer berühmten Menge eines eines anderen Substanzvorschriften titolante Reagens reagieren läßt.
40) warum die Reaktion der Neutralisation im tiration verwendet wird:
Sie wird folgender Anforderung 3 gerecht:
) ist fast komplette Reaktion eine.
B) wird der Zustand des Gleichgewichts oben in der kurzen Zeit verfangen.
c) wird die komplette Reaktion von der Tatsache dieses n° die Äquivalente Unterseite = n° der Säureäquivalente gekennzeichnet.
41) was die Bedeutung ist und was im Äquivalenzpunkt geschieht:
Im Punkt der Gleichwertigkeit das n° der niedrigen Äquivalente ist er dem n° der sauren Äquivalente, das gleich, das es sagen möchte, daß sie Platz vollständig gebend kennen sie neutralisiert werden, wem n° von wharves er dem n° von wharves gleich ist, sie der Substanz vom Halter anfängt. An solchem Punkt wird die Säure oder die Baseität der Lösung an die Eigenschaften von diesem kennt sie nur gebunden.
42) beschreiben das tiration einer starken Säure mit einer starken Unterseite:
Zum Äquivalenzpunkt, den sie Platz vollständig gebend neutralisiert werden, kennt sie wer ionisches im Wasser sie nicht reagieren und folglich die Lösung total Null ist, pH = die 7. Es ist nicht ein besonders folgender Zeiger bis 7 notwendig, warum die Lösung nicht Eigenschaft Auflagen keine hat, bevor kein nach dem gleichwertigen Punkt folglich pH=7 ein Punkt zur vertikalen Tangente ist.
43) beschreiben das tiration einer sauren schwachen Person mit einer starken Unterseite:
Zum Äquivalenzpunkt, den sie Platz zu vollständig gebend neutralisiert werden, kennt Haben sie grundlegende Eigenschaft. Vorher, daß der gleichwertige Punkt oben verfangen wird, wird die mannigfaltige Lösung langsam sein pH in wieviel festgesetzt von einer sauren schwachen Person und sein sie kennt, folglich wie eine Auflage benommen.
44) beschreiben das tiration von einer niedrigen schwachen Person mit einer starken Säure:
Zum Äquivalenzpunkt, den sie Platz zu vollständig gebend neutralisiert werden, kennt Haben sie Eigenschaft acide. Vorher, daß der gleichwertige Punkt oben verfangen wird, wird die mannigfaltige Lösung langsam sein pH in wieviel festgesetzt von einer niedrigen schwachen Person und sein sie kennt, folglich wie eine Auflage benommen.
45) beschreiben das tiration einer diprotico Säure stark mit einer starken Unterseite:
Eine Ionisierung wird vorher gehabt, die den Verlust von 1° das Proton der Säure feststellt, der pH zum questo Punkt ist berechenbar was anbetrifft, welche saure schwache Person, fortfahrend, die Unterseite vorzustellen es der Äquivalenzpunkt erreicht wird, in dem die Säure und Unterseite Platz vollständig gebend, um Haben sie zu kennen die Eigenschaft einer niedrigen schwachen Person neutralisiert werden und welches folglich, bevor das K Bvom indischen K A2das pOH geschätzt werden und schließlich der pH.
46) beschreiben das tiration einer diprotico sauren schwachen Person mit einer starken Unterseite:
Eine Ionisierung wird gehabt vorher, die den Verlust von
1° das Proton der Säure feststellt, der pH zum questo Punkt, den
berechenbar ist er von 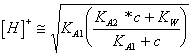 in wieviel das saure
Ableiten von 1ª das dissosciation anfolita ist und fährt fort, die
Unterseite vorzustellen es der Äquivalenzpunkt erreicht wird, in dem
die Säure und Unterseite Platz vollständig gebend, um Haben sie zu
kennen die Eigenschaft einer niedrigen schwachen Person neutralisiert
werden und welches folglich, bevor das K Bvom indischen K A2das pOH und dann der
pH geschätzt werden.
in wieviel das saure
Ableiten von 1ª das dissosciation anfolita ist und fährt fort, die
Unterseite vorzustellen es der Äquivalenzpunkt erreicht wird, in dem
die Säure und Unterseite Platz vollständig gebend, um Haben sie zu
kennen die Eigenschaft einer niedrigen schwachen Person neutralisiert
werden und welches folglich, bevor das K Bvom indischen K A2das pOH und dann der
pH geschätzt werden.
47) was ein Zeiger von pH ist:
Es ist eine Säure oder eine organische niedrige schwache Person und hat die Eigenschaft, die das ionizzata Molekül und sein ione nicht von der verschiedenen Farbe sind. Der Zeiger wird von einem Punkt von viraggio in der Korrespondenz gekennzeichnet, von der die Konzentration der ionizzata Form des Zeigers der Konzentration des Form nicht ionizzata gleich ist. In den Lösungen nimmt mehr acide betreffend ist den viraggio Punkt der Zeiger die Farbe des Form nicht ionizzata an, während in den basischen Lösungen es die Farbe der ionizzata Form annimmt, denn pH Vermittler, den er annimmt, daß ein Wert, den das colorimetria zur Kombination der Übermaßfarben verbindet, ein Zeigerbeispiel die Zitrone ist, die wir in das thé werfen und von ihm es die Farbe ändert.
48) dem Moleküle wie Zeiger von pH verwendet werden und deren Grundregel Nutzen zieht:
Die Farbe einer Substanz wird an seine Fähigkeit, entschlossene Mitglieder des Phantoms des Lichtes aufzusaugen gebunden und folglich sehen wir nur ergänzend das nicht aufgesogene Phantom. Die Absorption des Lichtes ist Vermächtnis zur Photonabsorption, wenn diese ein Atom investieren und ihre Energie an ein Elektron liefern, das bildet, um mehr es zu einem erhöhten energischen Niveau zu führen. Die aromatische Molekülart, die das Benzol zum delocalizzazione der Elektronen vorstellen einen kleineren Abstand zwischen den energischen Niveaus und Haltung, um Photonen gerade des Phantoms vom sichtbaren folglich aufzusaugen dankt.
49) das Formellegierung der Unterschied zwischen pH der Lösung und dem Punkt von viraggio zu den Konzentrationen des Zeiger nicht ionizzato und des ionizzato Zeigers:
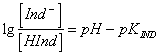 wo pKIND ein
charakteristischer Wert des entschlossenen Zeigers ist.
wo pKIND ein
charakteristischer Wert des entschlossenen Zeigers ist.
50) die ist er, stellte das Kriterium von gewählt vom Zeiger für einen Lösung fest:
Es ist notwendig, den Zeiger zu wählen, daß es einen Punkt von möglichem das folgende viraggio zum Wert des pH der Lösung hat.
51) beschreiben die Methode von conduttometrico tiration:
Von es ist eine Methode, die für die Übersicht des gleichwertigen Punktes auf der basiert Feststellung, die die ionische Leitfähigkeitvon H3 oder undvon OH- - sie ist betreffend die anderen ionischen maximal, und der in der Neutralisation in der Korrespondenz des Äquivalenzpunktes sie sich oben eine minimale Konzentration verfangen in, wieviel ersetzt von den ionischen sie kennen Sie, folglich zum Punktäquivalent ist die Leitfähigkeit der Lösung minimal.
52) als die Löslichkeit für das idrossidi wird geschätzt:
Zu halten ist notwendig, im Verstand, den das idrossidi freies OH-- als sie gegangen werden, um denen des Wassers hinzuzufügen, ist die Löslichkeit folglich Gleichgestelltes zur einzelnen Konzentration des catione und des pu², zum geschätztes Auferlegen zu sein, daß Sie das Ionenprodukt des Wassers respektieren.
53) während es geschätzt wird, kennt die Löslichkeit von sie kommend von von den schwachen Leuten der Säuren:
Zu halten ist notwendig, im Verstand, daß das Anion, das von der Ionisierung von ableitet, weiß, daß sie eine starke Unterseite folglich im Teil werden wiederverbunden mit H des Wassers sind, daß es gleichwertig ist zu sagen, das unterschlagen zu den Lösung Blättern des Anions kommt, das Ks wird gekippt und es folglich, habend, zum konstant zu bleiben verschoben, wird die Reaktion in Richtung zum entfernteren issolution von kennt sie in der Lösung. Nachdem alles, um Konto dieses Effektes zu halten es notwendig ist, um die Löslichkeit s des Anions für korrektiven Faktor R zu multiplizieren.
54)IST wieviel wert, kennt korrektiver Faktor R für sie der schwachen Leute der monoprotici Säuren:
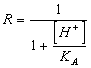 oder direkt die Löslichkeit durch
oder direkt die Löslichkeit durch 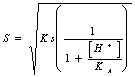
55) wievielIST korrektiven Faktor R kennt sie der schwachen Leute der diprotici für Säuren wert?
 oder direkt das Löslichkeit dalla
oder direkt das Löslichkeit dalla 
56)IST wieviel wert, kennt korrektiver Faktor R für sie der schwachen Leute der triprotici Säuren:
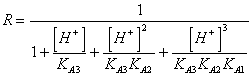
57) wieviel die Löslichkeit im Wasser einer sauren kleinen löslichen schwachen Person wertIST:
Es wird von der Summe der Konzentration der indissociato Säure und des Anions oder, leicht gegeben:
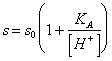 wo s0 die
Löslichkeit der indissociata Form der Säure sind.
wo s0 die
Löslichkeit der indissociata Form der Säure sind.
58) wieviel die Löslichkeit im Wasser von einer niedrigen kleinen löslichen schwachen Person wertIST:
Es wird von der Summe der Konzentration der indissociata Unterseite und des catione oder, leicht gegeben:
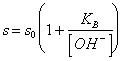 wo s0 die
Löslichkeit der indissociata Form der Unterseite sind.
wo s0 die
Löslichkeit der indissociata Form der Unterseite sind.
59) die die Betrachtungen sind, die die Crociani Methode für die Berechnung der Konzentrationen der Säuren und der Unterseiten verwendet:
) lieferte Etat der Massen, die Konto halten, das im Allgemeinen kommt, die Konzentration der indissociato Säure.
B) Etat der Aufladungen, die Konto halten, um jede Konzentration für das n° der Aufladungen des einzelnen ione zu multiplizieren.
c) Produziert von der Ks Löslichkeit.
d) Konstante der Ionisierung der Säuren
und) konstantes Kilowatt
f) in gelöster Form acida das OH- sind in den Summen unwesentlich [-].
g) in der basischen Lösung sind sie in den Summen [ H 3oder] unwesentlich.
h) poliprotici in den sauren Lösungen, in denen 1ª die Ionisierung am erheblichsten ist, kann es die sauren Konzentrationen der aufeinanderfolgenden Ionisierungen betreffend sind die Konzentration von 1ª vernachlässigt werden die Ionisierung.
